El metabolismo consiste en una serie de reacciones químicas ordenadas que se producen en los organismos con el fin de sintetizar macromoléculas a partir de moléculas sencillas, con la energía obtenida al romper los enlaces químicos de otras macromoléculas, sustancias de reserva o alimentos.
Como las sustancias que intervienen en estas reacciones son muy estables, es necesaria mucha energía para que se produzca dicha reacción porque si no, la velocidad de reacción sería nula o demasiado lenta. Eso se podría solucionar aumentando la temperatura, pero podría causar la muerte del organismo, por lo que los seres vivos utilizan unos biocatalizadores, las enzimas, que descienden la energía de activación necesaria para que se produzca la reacción, aumentando con ello su velocidad.
La actividad de las enzimas fue ya reconocida en los estudios iniciales de la digestión en el estómago, durante el período de 1780 a 1825.
En 1860 Pasteur fue el primero en hablar de las enzimas ya que descubrió que el proceso de fermentación alcohólica se realizaba gracias a la actuación de unos compuestos a los que llamó fermentos en referencia a la acción que ejercían. Pasteur postuló que dichos fermentos se hallaban ligados con la estructura y la vida de las células de levadura.
Posteriormente esta misma acción se describió también en diversos órganos y tejidos, y en 1877 Kühne propuso el nombre actual de enzimas para designar a estas sustancias.
En 1897 Büchner consiguió aislar, a partir de las células de levadura, esos fermentos descubiertos por Pasteur. Puso de manifiesto que estas importantes enzimas podían actuar independientemente de la estructura celular.
En 1926 Sumner aísla, en forma cristalina, una enzima, llamada ureasa, que interviene en la degradación de la urea. Sumner sugiere que todas las enzimas eran proteínas.
En 1930 Northrop aísla e identifica varias enzimas digestivas, pepsina, tripsina y quimiotripsina, estableciendo firmemente la naturaleza proteica de las enzimas.
A partir de esa fecha se han aislado multitud de enzimas y en la actualidad se conoce un número enorme de ellas.
Por lo tanto podemos definir a las enzimas como biocatalizadores específicos que disminuyen la energía de activación y aumentan la velocidad de las reacciones metabólicas, uniéndose a la molécula que se va a transformar, el sustrato, para formar una nueva sustancia, el producto.
Las enzimas cumplen las dos leyes comunes a todos los catalizadores:
a) No se alteran ni se consumen durante la reacción.
b) Favorecen que la misma cantidad de producto se obtenga en menos tiempo, sin desplazar la constante de equilibrio para que se obtenga más producto.
Las enzimas, a diferencia de los catalizadores no biológicos, presentan una gran especificidad, actúan a temperatura ambiente y consiguen un aumento de la velocidad de reacción de un millón a un trillón de veces.
También existen otros biocatalizadores de naturaleza ribonucleoproteica llamados ribozimas, capaces de catalizar reacciones de corte y empalme de segmentos de ARN.
1. Estructura de las enzimas
A excepción de las ribozimas, todas las enzimas son proteínas globulares, pudiendo estar formadas únicamente por cadenas polipeptídicas o contener, además, otro grupo no proteico.
Según su estructura, se pueden diferenciar dos tipos de enzimas:
a) Enzimas simples u holoproteinas, enzimas formadas solamente por polipéptidos.
b) Enzimas conjugadas u holoenzimas, enzimas formadas por la asociación de una parte polipeptídica o apoenzima y de una parte no polipeptídica o cofactor. Estas enzimas necesitan un componente no proteico, el cofactor, para poder realizar su actividad. Si esa enzima no tiene el cofactor no es activa y se denomina apoenzima. Cuando la enzima está unida a su cofactor se llama holoenzima y es activa.
Distinguimos en una holoenzima:
1) Apoenzima, parte proteica que se encarga de proporcionar la estructura espacial específica que permite la unión a los sustratos, moléculas sobre las que actúan las enzimas en las reacciones químicas.
2) Cofactor, parte no proteica que forma los componentes enzimáticos que llevan a cabo la reacción. Los cofactores pueden ser:
a) Cofactores inorgánicos, como los iones metálicos (Fe2+, Cu2+, Mn2+, Zn2+,…), que se encuentran en pequeñas cantidades (menos de un 0,1 por 100, por lo que son oligoelementos). Por ejemplo, el Zn en las carboxipeptidasas, el Mg en las quinasas, el K en la piruvatoquinasa, etc.
b) Cofactores orgánicos, como:
· Coenzimas, moléculas que actúan asociadas débilmente a enzimas, como, por ejemplo, el FAD+, el NAD+, las vitaminas, etc. Así pues, los oligoelementos y las vitaminas resultan imprescindibles para los organismos, ya que son cofactores de diversas enzimas.
· Grupos prostéticos, moléculas fuertemente unidas por enlaces covalentes a la cadena polipeptídica, como por ejemplo, el grupo hemo en los citocromos, el grupo hemino en las peroxidasas, etc.
El centro activo es la región de la enzima que se une al sustrato, y donde se produce la catálisis. Tiene las siguientes características:
a) Es una parte muy pequeña del volumen total de la enzima.
b) Está formado por aminoácidos que quedan próximos por los repliegues de la cadena polipeptídica, aunque estuvieran lejanos en la cadena original.
c) Tiene una estructura tridimensional en forma de hueco en el que encaja el sustrato.
d) Algunos aminoácidos tienen radicales con afinidad química por el sustrato, por lo que lo atraen y establecen enlaces débiles con él. Cuando se rompen estos enlaces, los productos se separan del centro activo.
El centro activo de la enzima está formado por el centro de fijación y el centro catalítico, que suelen estar juntos. Unos aminoácidos se encargan de unir la enzima al sustrato mediante enlaces débiles (iónicos, puentes de hidrógeno, fuerzas de Van der Waals), y otros se encargan de la catálisis enzimática, transformando el sustrato en producto.
Las enzimas están formadas por tres tipos de aminoácidos:
a) Aminoácidos estructurales, no tienen función dinámica.
b) Aminoácidos de fijación, forman enlaces débiles con el sustrato. Constituyen el centro de fijación de la enzima.
c) Aminoácidos catalizadores, que se unen al sustrato mediante enlaces covalentes, de forma que en dicho sustrato se debilita la estructura molecular favoreciendo su ruptura. Constituyen el centro catalítico de la enzima.
Todas las reacciones químicas necesitan una energía de activación para poder romper los enlaces de unas sustancias iniciales, denominadas reactivos o sustratos (S), para transformarlas en unas sustancias finales o productos (P).
Las enzimas, como el resto de catalizadores, aceleran la velocidad de las reacciones químicas disminuyendo la energía de activación. Así, reaccionan un mayor número de moléculas y la reacción se acelera.
La transformación de reactivo a producto no es directa, sino que hay un paso intermedio en el que el reactivo se activa, y sus enlaces se debilitan. Este estado de transición posee una energía superior a la de los reactivos y a la de los productos constituyendo entre ellos una barrera energética que debe superarse para que la reacción tenga lugar.
Definimos la velocidad de reacción como la cantidad de producto que se forma por unidad de tiempo en una reacción química.
Definimos la energía de activación como la energía que se debe suministrar a los reactivos para que la reacción se produzca.
Las enzimas se encargan de rebajar la energía de activación para llegar fácilmente al complejo activado y permitir que la reacción se realice. Sin la presencia de la enzima no sería posible alcanzar el estado de transición.
Esta energía de activación es necesaria tanto en las reacciones endotérmicas como exotérmicas para llegar al complejo activado, aunque, globalmente, unas necesitan energía y otras la desprenden.
En las reacciones espontáneas, la energía de activación es tan baja que se obtiene de la propia energía cinética de las moléculas o incluso de la luz que incide en el lugar de reacción. En las reacciones no espontáneas, es necesario aplicar calor para poder llegar a esa energía de activación, mucho más alta.
Las enzimas pueden actuar de dos formas:
a) Fijándose al sustrato mediante enlaces fuertes (covalentes), para debilitar sus enlaces y que no sea necesaria tanta energía para romperlos.
b) Atrayendo a los sustratos hacia la enzima para que aumente la posibilidad de encuentro y facilitar la reacción.
Las enzimas, después de la reacción, dejan libres los productos para poder unirse a otros sustratos. Las enzimas suelen formar complejos multienzimáticos, de forma que el producto de una enzima constituye el sustrato de la siguiente, por lo que no se necesita una alta concentración del sustrato.
En una reacción bioquímica catalizada por una enzima, siempre se produce la unión del sustrato a la enzima, formando el complejo enzima-sustrato, imprescindible para que la reacción química pueda llevarse a cabo. Se puede representar mediante la ecuación:
E + S → ES → E + P
Donde la E representa a la enzima, S al sustrato, P al producto de la reacción, y ES es el complejo intermedio enzima-sustrato.
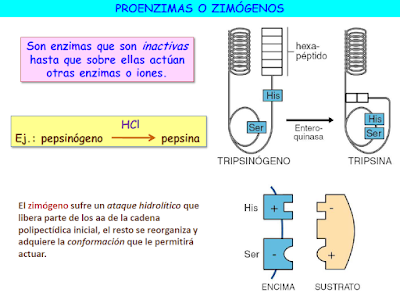
Algunas enzimas no son operativas hasta que son activados por otras enzimas o iones, como por ejemplo, el pepsinógeno, que el HCl transforma en pepsina. Estas enzimas se denominan zimógenos o proenzimas.
Resumiendo, la enzima cataliza una reacción al unirse con el sustrato que puede resumirse en tres etapas:
A) El sustrato se une a la apoenzima (parte proteica) formando el complejo enzima-sustrato (ES). Hay un alto grado de especificidad, de modo que para cada tipo de sustrato y de reacción se necesita una enzima concreta. Cada enzima puede catalizar un solo tipo de reacción, actuando sobre un único sustrato o grupo muy reducido de sustratos.
La especificidad se establece a dos niveles:
1) Especificidad de acción: Es decir un enzima solo puede realizar un determinado tipo de reacción: hidrólisis, óxido-reducción, etc.
2) Especificidad de sustrato: Esto significa que cada enzima sólo puede actuar sobre un sustrato, o sobre un reducido número de sustratos. Esta especificidad puede ser:
· Absoluta. El enzima actúa sobre un único sustrato. Ej. ureasa actúa sobre la urea y la desdobla en CO2 y NH3.
· De grupo. El enzima actúa sobre un grupo de sustratos que presentan un determinado tipo de enlace. Ej las descarboxilasas eliminan un grupo CO2 de los aminoácidos.
· Estereoquímica. La enzima actúa sobre un estereoisómero y no sobre el otro. Ej. la aspartasa actúa sobre el L-aspártico y no sobre la forma D.
Aunque se ha dicho que cada enzima solo puede catalizar un único tipo de reacción, la ribulosa-1,5-bisfosfatocarboxilasaoxigenasa o "rubisco", la proteína más abundante de la Tierra y que se encuentra en el estroma del cloroplasto, puede actuar como:
· Carboxilasa, catalizando la fijación de CO2 a la ribulosa bifosfato en la fotosíntesis.
· Oxigenasa, en la fotorrespiración, cuando hay una concentración alta de O2 y baja de CO2.
La especificidad enzimática se debe a la forma del centro activo de la apoenzima donde se acopla el sustrato.
En 1894, Emil Fischer propuso la hipótesis de la llave y la cerradura para explicar la especificidad enzimática. Según esta hipótesis la especificidad entre la enzima y el sustrato es como la que existe entre una llave y su cerradura, se pensaba que el centro activo tenía una forma tridimensional determinada y el sustrato sería complementario a él y encajaría perfectamente.
En 1958, Daniel Koshland propuso la hipótesis del ajuste inducido o de la mano y el guante. Dice que la especificidad radica en los aminoácidos de unión del centro activo, que son los encargados de establecer enlaces débiles con el sustrato. Realizada la fijación el enzima posee libertad para cambiar su forma y amoldarse al sustrato de tal manera que el centro activo quede correctamente situado. Esta teoría afirma que no hay una adaptación predeterminada como ocurre en el modelo de la llave-cerradura, sino una adaptación inducida por los aminoácidos de unión. Este modelo es el más aceptado.
Las investigaciones más recientes sobre la catálisis enzimática llevan a algunos autores a afirmar que, en algunos casos, los enzimas no son exactamente complementarios con sus sustratos sino más bien con las especies del estado de transición, es decir, las interacciones débiles que se forman entre el enzima y su sustrato son óptimas en el estado de transición. (Modelo de estabilización del Estado de transición o del apretón de manos)
Cuando el sustrato penetra en el centro activo del enzima se forman algunas interacciones débiles entre ambos; a partir de este momento, cualquier distorsión del sustrato tendente a alcanzar el estado de transición se verá acompañada por el establecimiento de interacciones débiles adicionales energéticamente favorables.
Así, el coste energético que supone llevar al sustrato al estado de transición es "pagado" gracias al descenso de energía libre asociado con el establecimiento de dichas interacciones débiles.
Una vez más, el concepto de energía de fijación resulta crucial para entender cómo los enzimas rebajan la barrera de energía de activación para aumentar la velocidad de una reacción química. Es conveniente resaltar el hecho de que la distorsión del sustrato a la que hemos hecho referencia no es sólo estructural, es decir, no afecta sólo a la forma de la molécula, ángulos o distancias de enlace, sino también electrónica: la formación de interacciones débiles puede provocar cambios en la distribución global de la carga eléctrica, aparición de cargas parciales donde antes no las había, etc
La unión de la enzima al sustrato es reversible, pues una parte del complejo enzima sustrato (ES) se disocia y, debido precisamente a esa reversibilidad, esta primera etapa es más lenta.
E + S ↔ ES
B) Una vez formado el complejo enzima-sustrato, interviene el cofactor para llevar a cabo la reacción y se obtiene el producto final (P). Esta etapa es muy rápida e irreversible.
ES → E+P
Si no hay cofactores, la acción catalítica la realizan algunos aminoácidos del propio centro activo.
C) El producto se libera del centro activo y la apoenzima queda libre para volver a unirse a nuevas moléculas de sustrato. La coenzima puede liberarse intacta o liberarse quedando modificada.
3. Cinemática enzimática de Michaelis-Menten
Los métodos experimentales para conocer la actividad catalítica de los enzimas son cada vez más complejos y sofisticados. Sin embargo, el método más antiguo utilizado en enzimología, desarrollado por Leonor Michaelis y Maud Menten, consiste en analizar como varía la velocidad de las reacciones catalizadas enzimáticamente en función de algunos parámetros experimentales como la concentración del sustrato o la del propio enzima, lo que globalmente se conoce con el nombre de cinética enzimática.
En toda reacción catalizada por un enzima, si se mantiene constante la concentración del mismo [E], la velocidad de la reacción aumenta exponencialmente al incrementarse la concentración del sustrato [S], ya que al existir más moléculas de sustrato es más probable el encuentro con el enzima y la formación del complejo E-S.
Este aumento de velocidad es rápido para concentraciones bajas de sustrato y, a medida que este aumenta, se va haciendo más lento hasta que la concentración del sustrato alcanza un cierto valor, a partir del cual, aunque aumente la concentración del mismo, no aumenta la velocidad de la reacción. Esto es debido a que el enzima esta saturada por el sustrato; es decir, todas las moléculas del enzima están unidas al sustrato formando el complejo E-S. Cuando ocurre esto, se dice que la reacción ha alcanzado la velocidad máxima.
En 1913 Leonor Michaelis y a Maud Menten estudiaron la variación de la velocidad de una reacción enzimática en función de la concentración del sustrato y propusieron la siguiente ecuación, que es válida para concentraciones de sustrato no saturante.
Donde:
V es la velocidad de la reacción para una determinada concentración
de sustrato.
Vmax es la velocidad máxima de la reacción.
[S] es la concentración del sustrato.
Km es una constante denominada constante de Michaelis-Menten (característica de cada enzima).
En la reacción enzimática, la etapa limitante (la más lenta) corresponde a la unión del sustrato al centro activo y la formación del complejo ES porque es reversible. Existe una constante de equilibrio para esta etapa (ke) pero para calcularla es preciso conocer la concentración de enzima libre y la concentración de enzima que ha formado el complejo ES (lo que es imposible de medir).
Sin embargo podemos establecer que cuando la velocidad de reacción es justo la mitad de la Vmax [E] = [ES] (porque la mitad de las enzimas estarán con el centro activo ocupado por el complejo ES). En este momento la ke = [S] y a la constante así obtenida se le denomina KM o constante de Michaelis-Menten.
La constante de Michaelis-Menten o KM se define como la concentración de sustrato [S] para la cuál la reacción alcanza la velocidad semimáxima. Se mide en unidades de concentración.
La Km nos indica la afinidad de un enzima por su sustrato:
a) Si Km es alta indica que el enzima tiene poca afinidad por el sustrato ya que se necesita una concentración de sustrato elevada para alcanzar la mitad de la velocidad máxima.
b) Si Km es baja indica que el enzima tiene mucha afinidad por el sustrato ya que se necesita una concentración de sustrato baja para alcanzar la mitad de la velocidad máxima.
Calcular la KM es muy sencillo siempre que tengamos los datos experimentales de la velocidad máxima de reacción y de la concentración de sustrato [S] que son fácilmente controlables. Solo tenemos que calcular la mitad de esa velocidad máxima (½ Vmax) y observar a que valor de [S] corresponde.
Sin embargo, la ecuación de Michaelis-Menten es poco útil si queremos determinar la velocidad máxima de una reacción ya que ésta nunca se va a alcanzar. Por la misma razón es difícil determinar la KM. Para evitar esto, Lineweaver y Burk transformaron la ecuación de Michaelis-Menten utilizando los inversos de ambos términos, consiguiendo, de esta manera, una ecuación similar a la de una recta (ecuación de Lineweaver-Burk).
Al representar gráficamente dicha ecuación se pueden hallar fácilmente los valores de la velocidad máxima y la KM.
La velocidad de las reacciones enzimáticas depende de una serie de factores, entre los que están los siguientes: temperatura, pH, concentración de la enzima, activadores e inhibidores.
Las enzimas, por el hecho de ser proteínas, van a actuar en función de la temperatura, de manera que presentan una temperatura mínima, por debajo de la cual no muestran actividad; una temperatura óptima, a la cual la actividad es máxima, y una temperatura máxima por encima de la cual tampoco muestran actividad ya que se produce la denominada desnaturalización que conlleva la desorganización de los centros activos y la pérdida de funcionalidad.
Como se observa en la gráfica, la temperatura óptima está más próxima a la temperatura máxima porque cuanto mayor es la temperatura a mayor velocidad se desarrolla cualquier reacción química porque aumenta el movimiento de las moléculas y el número o frecuencia de los encuentros intermoleculares.
La temperatura óptima de cada enzima resultará de la conjugación de ambos factores, y eso varía según los organismos. En la especie humana, la temperatura óptima suele ser la temperatura corporal.
De forma similar al de la temperatura existe un pH mínimo, por debajo del cual la enzima no muestra actividad; un pH óptimo, al cual la actividad es máxima; y un pH máximo. En este caso debemos tener en cuenta que el pH óptimo es prácticamente el intermedio entre el pH mínimo y el pH máximo y que la enzima se desnaturalizará tanto si superamos el pH mínimo como el pH máximo
En la mayor parte de los casos el pH óptimo está próximo a la neutralidad, en consonancia con el pH intracelular, pero existen enzimas con pH óptimo muy diverso según sea el pH del medio en el que habitualmente actúan (los enzimas proteolíticos del jugo gástrico tienen pHs óptimos próximos a 2 ya que este es el pH de dicho jugo). Por último existen algunos enzimas a los que el pH no afecta en absoluto.
La actividad de una enzima es directamente proporcional a su concentración, siempre que exista cantidad suficiente de sustrato. La velocidad de la reacción, por tanto, aumenta conforme aumenta la concentración de la enzima.
Cuando lo que se modifica es la concentración de sustrato, la actividad de la enzima crece hasta alcanzar un valor máximo, a partir del cual la velocidad de la reacción no varía aunque siga aumentando la concentración de sustrato, ya que se produce un efecto de saturación de la enzima por el sustrato. El número de moléculas de enzima siempre va a ser menor que el número de moléculas de sustrato, por lo que llegará un momento, en el curso de la reacción, en que todas las moléculas de la enzima estén unidas al sustrato, ese momento representará la velocidad máxima. Este fenómeno se conoce como inhibición por sustrato.
Como las reacciones enzimáticas son reacciones de equilibrio, una elevada concentración de producto va a producir un efecto de reducción de la actividad de la enzima, es lo que se conoce como inhibición por producto.
4.4 Activadores
La presencia de activadores permite que ciertas enzimas que se mantenían inactivas lleven a cabo su acción (es decir que se activen). Normalmente, la unión del activador hace que el centro activo adquiera la estructura adecuada para el acoplamiento del sustrato (veremos esto de forma más detallada cuando estudiemos el alosterismo y la modulación enzimática). Algunos cationes como el Mg2+ o el Ca2+, desempeñan un papel importante como activadores enzimáticos.
También pueden actuar como activadores diversas moléculas orgánicas, incluso el propio sustrato. Este último caso es muy frecuente e interesante porque es el propio sustrato de la reacción el que activa y pone en funcionamiento a la enzima provocando su propia metabolización.
4.5 Inhibidores
Dada la mayor complejidad y extensión de este punto lo vamos a estudiar en los siguientes puntos.
Existen una serie de sustancias, llamadas inhibidores, que inhiben o anulan la acción de los enzimas sin ser transformados por ellos. Su estudio resulta de gran utilidad a la hora de comprender los mecanismos de catálisis, la especificidad de los enzimas y otros aspectos de la actividad enzimática.
La inhibición enzimática puede ser irreversible o reversible, esta última comprende a su vez tres tipos: inhibición competitiva, acompetitiva y no competitiva.
5.1 Inhibición irreversible
Algunos inhibidores se combinan de modo permanente con el enzima uniéndose covalentemente a algún grupo funcional esencial para la catálisis con lo que el enzima queda inactivado irreversiblemente (se ha producido una alteración estructural de la enzima). El estudio de este tipo de inhibidores ha resultado de gran utilidad para identificar los grupos funcionales esenciales para la catálisis en aquellos enzimas a los que inactivan.
Este tipo de inhibición se conoce también como "envenenamiento" del enzima. Por ejemplo algunos compuestos organofosforados tóxicos llamados venenos nerviosos, que se utilizan como insecticidas, actúan inhibiendo irreversiblemente al enzima acetilcolinesterasa, la cual interviene en la actividad del sistema nervioso. Se sabe que estos compuestos organofosforados inactivan al enzima formando un enlace éster fosfórico con el grupo hidroxilo de un determinado resto del aminoácido serina, lo que demuestra que ese grupo funcional es esencial para la catálisis.
Puede ocurrir que el inhibidor se una a la enzima inactivándola temporalmente. Se produce, en este caso, una inactivación funcional sin que se altere la estructura de la enzima, de modo que, cuando el inhibidor se separe de ella, esta quedará de nuevo libre para realizar su función catalítica.
Este tipo de inhibición se lleva a cabo por tres mecanismos diferentes que reciben respectivamente los nombres de inhibición competitiva, acompetitiva y no competitiva.
Estos tres mecanismos de inhibición pueden distinguirse experimentalmente por los efectos que produce el inhibidor sobre la cinética de la reacción, cinética que puede analizarse mediante la ecuación de la velocidad enzimática, propuesta por Michaelis-Menten, y la representación gráfica de esta, propuesta por Lineweaver-Burk.
La característica básica de este tipo de inhibición es que el inhibidor puede unirse a la enzima libre de tal modo que compite con el sustrato normal por unirse al centro activo. Un inhibidor competitivo reacciona reversiblemente con la enzima para formar el complejo enzima-inhibidor, análogo al complejo enzima-sustrato. La molécula del inhibidor no resulta químicamente alterada por la enzima.
La inhibición competitiva se reconoce experimentalmente con facilidad, debido a que el porcentaje de inhibición, para una concentración de inhibidor constante, disminuye al incrementarse la concentración de sustrato.
La presencia de un inhibidor competitivo aumenta la KM de la reacción, es decir provoca que sean necesarias concentraciones de sustrato superiores para que se alcance la Vmax pero no varía esta.
En este tipo particular de inhibición el inhibidor no se combina con la enzima libre ni afecta a su reacción con el sustrato normal, sino que se combina con el complejo enzima-sustrato para formar un complejo inactivo enzima-sustrato-inhibidor, el cual no experimenta su transformación posterior en el producto natural de la reacción.
La característica de este tipo de inhibición es que se modifican KM y Vmax, pero sin que se modifique la pendiente de la ecuación, al aumentar la [I].
Este tipo de inhibición es poco frecuente en las reacciones de un sólo sustrato, pero es más corriente en las reacciones con dos sustratos. Como puede observarse en la figura al aumentar la concentración del inhibidor, la Vmax decrece.
Un inhibidor no competitivo puede combinarse con la enzima libre o bien con el complejo enzima-sustrato, interfiriendo con la acción de ambos. Los inhibidores no competitivos se unen a un centro del enzima distinto del centro activo, a menudo para deformar a la enzima, de modo que no pueda formarse el complejo enzima-sustrato a su velocidad normal, y que una vez formado no se descomponga a su velocidad habitual para liberar los productos de reacción.
El tipo más normal es la inhibición producida por reactivos que pueden combinarse libremente con algún grupo funcional, situado fuera del centro activo de la enzima, que sea esencial para mantener la conformación tridimensional de la enzima, dicha conformación es la que permite la existencia del centro catalítico
En este tipo de inhibición se modifica la Vmax sin que se modifique la KM al aumentar la [I].
La célula es una máquina química que debe ser capaz de autoajustarse o regular su propio funcionamiento para no desperdiciar tiempo ni energía en realizar procesos que no le son útiles en un momento dado, siguiendo así un principio de máxima economía molecular. Este autoajuste se lleva a cabo a varios niveles entre los que destaca la regulación de la propia actividad enzimática.
Existen dos tipos principales de enzimas reguladores: los enzimas alostéricos y los enzimas modulados covalentemente. Ambos tipos son responsables de alteraciones en el estado metabólico de las células en intervalos cortos de tiempo (los enzimas alostéricos en cuestión de segundos, los modulados covalentemente en cuestión de minutos).
Los enzimas alostéricos son aquellos que, además del centro activo mediante el cual interactúan con el sustrato, poseen otro centro de unión llamado centro alostérico mediante el cual interactúan con otra molécula denominada efector o modulador.
La interacción del modulador con el centro alostérico es tan específica como lo es la interacción del sustrato con el centro activo y también está basada en la complementariedad estructural. Los enzimas alostéricos presentan pesos moleculares en general superiores a los de otros enzimas y en la mayor parte de los casos son proteínas oligoméricas, es decir están formados por varias subunidades (normalmente en número par).
Los moduladores alostéricos pueden ser de dos tipos:
a) Unos estimulan la actividad del enzima al unirse al centro alostérico, reciben el nombre de moduladores positivos o activadores.
b) Otros la inhiben y se llaman moduladores negativos o inhibidores. Los inhibidores alostéricos no responden a ninguno de los modelos de inhibición enzimática estudiados en el apartado anterior.
Los enzimas alostéricos presentan siempre dos formas, una activa y otra inactiva, interconvertibles por efecto del modulador. Existen dos tipos de control alostérico:
a) control heterotrópico que se da cuando el modulador es una molécula diferente del sustrato.
b) control homotrópico que se da cuando el modulador es el propio sustrato.
En ambos casos el modulador puede ser positivo o negativo.
Los enzimas con control homotrópico poseen dos o más centros de unión para el sustrato; en ellos la interconversión entre las formas activa e inactiva depende de cuántos sean los centros de unión que estén ocupados por moléculas de sustrato.
Presentan un efecto cooperativo entre la subunidades, es decir que si se activa o inhibe una de ellas provoca el mismo efecto en las demás.
En las enzimas alostéricas la cinética de las reacciones es diferente a la de las demás enzimas, la gráfica de la velocidad frente al sustrato es una curva sigmoidea en lugar de hiperbólica como ocurre en las demás enzimas.
Los enzimas alostéricos desempeñan un papel muy importante en la regulación de las reacciones metabólicas, suelen actuar en puntos estratégicos de las rutas metabólicas como son: la primera reacción de una ruta metabólica o los puntos de ramificación de una ruta metabólica.
El propio sustrato de la primera reacción es el que actúa como activador alostérico, al unirse con el enzima produce el cambio que da lugar a la conformación activa. Se trataría aquí de un control homotrópico mediante modulador positivo.
Otra forma de regulación del metabolismo mediante enzimas alostéricos es la la inhibición por el producto final, también llamada retroinhibición o control feed-back. En ella, el producto final de una ruta metabólica inhibe alostéricamente al enzima que cataliza la primera reacción de dicha ruta, interrumpiendo así su propia síntesis cuando ésta ya no es necesaria. Este tipo de control es muy rentable para la célula, ya que no se interrumpe solamente la síntesis del producto final sino la de todos los intermediarios. Se trata de un control heterotrópico mediante un modulador negativo.
Aunque existen enzimas alostéricos monovalentes, que responden a un sólo modulador, la inmensa mayoría son enzimas polivalentes, que poseen varios centros alostéricos mediante los cuales interactúan con distintos moduladores positivos y/o negativos, presentando un tipo de control mixto homotrópico-heterotrópico.
Los enzimas modulados covalentemente también presentan dos formas, una activa y otra inactiva, que son interconvertibles por modificación covalente de sus estructuras catalizada por otros enzimas, denominados enzimas moduladores.
Tal modificación suele consistir en la adición o eliminación de un grupo químico esencial para la catálisis (generalmente un grupo fosfato, metilo, adenilato u otros) de manera que el enzima modulado se activa cuando está unido a dicho grupo y se inactiva cuando éste se elimina. En la mayor parte de los casos son necesarios dos enzimas moduladores diferentes, uno que activa el enzima modulado y otro que lo inactiva.
Un ejemplo clásico de modulación covalente lo constituye el enzima glucógeno-fosforilasa, que actúa en el metabolismo de los glúcidos liberando unidades de glucosa-1-P a partir de las cadenas polisacarídicas del glucógeno. La glucógeno-fosforilasa es activada por un enzima modulador, la fosforilasa-quinasa, que une covalentemente un grupo fosfato a un resto específico de serina en cada una de las dos subunidades del enzima modulado. Otro enzima modulador, la fosforilasa-fosfatasa, escinde hidrolíticamente dichos grupos fosfato desactivando así el enzima.
La modulación covalente tiene la ventaja de que puede utilizarse para amplificar una señal química, ya que una sola molécula del enzima modulador puede activar o desactivar a muchas moléculas del enzima modulado, que a su vez podrán actuar o no sobre un elevado número de moléculas de sustrato, produciéndose así lo que se conoce como efecto cascada.
En muchos casos, los enzimas moduladores a su vez pueden activarse o desactivarse como respuesta a una señal hormonal. Por ejemplo, la hormona denominada adrenalina actúa sobre receptores específicos de la membrana de las células musculares desencadenando un proceso en el que están implicados varios enzimas moduladores que a su vez resultan modulados covalentemente por otros enzimas moduladores de un nivel superior. El resultado final de dicho proceso es una degradación masiva de glucógeno a glucosa-1-P destinada a la producción de energía para las células musculares. De este modo, una débil señal química, consistente en unas pocas moléculas de hormona, es amplificada en varios escalones para producir un efecto metabólico de grandes proporciones.
Un caso particular de este tipo de regulación es la la activación covalente de los zimógenos. Como ya estudiamos, algunos enzimas se sintetizan dentro de las células en formas inactivas denominadas zimógenos. Una vez secretados al exterior de la célula son activados mediante la escisión hidrolítica catalizada enzimáticamente de algunos péptidos de su cadena polipeptídica. Este tipo de activación es irreversible. El ejemplo clásico de este tipo de regulación es el de los enzimas digestivos pepsina, tripsina y quimotripsina que, con el objeto de que evitar que lleven a cabo su actividad degradativa en el interior de las células, se sintetizan en forma de sus respectivos zimógenos inactivos y sólo se activan una vez han sido secretados al tracto digestivo.
Los procesos metabólicos que tienen lugar en los seres vivos se componen generalmente de unas secuencias de reacciones encadenadas que constituyen las rutas metabólicas, de tal forma que el producto final de una reacción es el sustrato de la siguiente.
Estas rutas pueden ser largas, por lo que el tiempo para llevarlas a cabo sería elevado. Para que las reacciones se produzcan de forma óptima, existen diversos mecanismos que permiten aumentar la eficacia de la acción enzimática, entre las que destacan las siguientes:
a) Compartimentación celular; las enzimas implicadas en algunos procesos metabólicos importantes se localizan juntas en estructuras membranosas (orgánulos celulares) del citoplasma celular, donde se encuentran en mayor concentración que si estuvieran dispersas por el citoplasma.
De esta forma, se asegura la consecución del proceso y el mantenimiento de unas condiciones ambientales de pH, concentración de iones, …, adecuadas para la actividad enzimática. Esta es la gran ventaja evolutiva de la presencia de orgánulos citoplasmáticos en las células eucarióticas.
b) Reacciones en cascada; como ya vimos en el punto 6, si el producto de una reacción enzimática actúa como enzima de otra reacción, cuyo producto, a su vez, es la enzima de una nueva reacción, y así sucesivamente, la eficacia de la actividad enzimática es mayor, ya que el número de moléculas obtenidas aumenta en cada paso de forma considerable.
Como ya dijimos, las reacciones en cascada son características de aquellos procesos que tienen que realizarse en un lapso de tiempo muy breve como, por ejemplo, la coagulación sanguínea en la que la red de fibrina debe generarse rápidamente para minimizar la pérdida de sangre.
c) Complejos multienzimáticos; la agrupación de las enzimas que llevan a cabo reacciones consecutivas de una ruta metabólica en un complejo único permite realizar el proceso completo con gran rapidez, ya que nada más obtener un producto, este puede actuar como sustrato de la nueva reacción al estar en contacto con la enzima correspondiente y poder acceder de forma inmediata a su centro activo.
Un ejemplo de complejo multienzimático es el de la piruvato-deshidrogenasa que descarboxila, oxida y activa el ácido pirúvico para formar acetil-CoA, que ingresará al ciclo de Krebs (como veremos en el tema de catabolismo).
d) Existencia de isozimas; en ocasiones, aparecen moléculas enzimáticas que, aun teniendo la misma acción catalítica, poseen KM diferentes (isozimas), lo que hace que su velocidad de reacción sea distinta. Se van a localizar en aquellos orgánulos que requieren velocidades determinadas en estas reacciones químicas.
Durante algún tiempo, para nombrar a las enzimas se añadía la terminación -asa- al nombre del sustrato sobre el que actuaba (urea → ureasa).
Con el paso del tiempo y al ir descubriéndose un número elevado de enzimas se hizo necesario establecer una clasificación sistemática. Para ello se crea la I. E. C. (Comisión Internacional de las Enzimas), que las clasifican en 6 clases:
En esta clase se agrupan todas las enzimas que intervienen en reacciones de transferencia electrónica, en las que un compuesto gana electrones y otro los pierde. A su vez se subdividen en:
a) Oxidasas o reductasas; intervienen transfiriendo electrones desde un dador electrónico (el agente reductor) a un aceptor electrónico (el agente oxidante). Son enzimas que llevan a cabo reacciones de óxido-reducción.
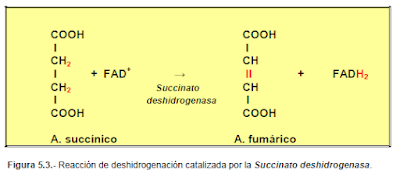
b) Deshidrogenasas; son enzimas oxidantes que separan átomos de hidrógeno del sustrato y que suelen actuar ligadas al NAD+, NADP+ y FAD+, (coenzimas de carácter vitamínico).
Catalizan reacciones en las que se transfiere un grupo funcional, distintos del hidrógeno, desde un sustrato a otro.
Catalizan reacciones de hidrólisis, es decir, de ruptura de algún tipo de enlace introduciendo grupos OH- e H+ (ligadas al agua).
Catalizan reacciones de ruptura o de formación de compuestos sin que intervenga el agua.
Catalizan reacciones en las que se produce una reconstrucción espacial de un compuesto sin que cambie su fórmula empírica (isómeros).
Catalizan reacciones en las que se forman o rompen compuestos gracias a la energía liberada al romperse una molécula de ATP.
Las vitaminas son un grupo de sustancias orgánicas, de distinta composición, que, en general, no podemos sintetizar, o lo hacemos en cantidad insuficiente, por lo que es necesario ingerirlas en la dieta.
Aunque son imprescindibles para la vida (“vita”), sólo se necesitan en pequeñas cantidades. Las vitaminas son nutrientes que, junto con otros elementos nutricionales, actúan como catalizadoras de todos los procesos fisiológicos, actuando algunas como cofactores de las enzimas.
Las vitaminas se alteran con facilidad con los cambios de temperatura, la luz, o los almacenamientos prolongados. Por ejemplo, cocer los alimentos reduce a la mitad la cantidad de vitaminas, por lo que es necesario ingerir alimentos frescos, como frutas y ensaladas.
A veces, no podemos tomar directamente las vitaminas, sino que están en forma de provitaminas, que se transformarán para dar lugar a las vitaminas.
Los requisitos mínimos diarios de las vitaminas no son muy altos, se necesitan sólo dosis de miligramos o microgramos, pero tanto su déficit como su exceso pueden ocasionar problemas:
a) Avitaminosis: carencia total de una vitamina determinada.
b) Hipovitaminosis: carencia parcial de una vitamina determinada.
c) Hipervitaminosis: exceso de una vitamina determinada.
Las trece vitaminas se pueden clasificar según su solubilidad en:
a) Vitaminas liposolubles (A, D, E y K).
b) Vitaminas hidrosolubles (complejo vitamínico B y la vitamina C).
Las vitaminas liposolubles son moléculas lipídicas y, por tanto, tienen baja densidad, son insolubles en agua y solubles en disolventes orgánicos, como grasas y aceites.
Pueden almacenarse en el hígado y en la grasa del cuerpo, por lo que no es necesario tomarlas todos los días, puesto que es posible, tras un consumo suficiente, subsistir una época sin su aporte.
Si se consumen en exceso (más de 10 veces las cantidades recomendadas) pueden resultar tóxicas porque no se eliminan por la orina y es factible acumular cantidades demasiado elevadas.
Pertenecen a este grupo las vitaminas A, D, E y K.
Conocida también como vitamina antixeroftálmica.
Fuentes: Se encuentra en alimentos de origen animal y vegetal, aunque en éstos se encuentra en forma de provitamina. Se encuentra en el hígado, yema de huevo, lácteos, zanahorias, espinacas, brócoli, lechuga, albaricoques, melón. Se deteriora con la cocción.
Acción: Protege los tejidos epiteliales: mucosas, piel… Además es necesaria para la percepción lumínica, y la formación del colágeno de los huesos.
Déficit: La carencia de esta vitamina provoca la aparición de infecciones en los tejidos epiteliales y la xeroftalmia (sequedad de la córnea). La falta de vitamina A produce un empobrecimiento de la cantidad de retineno, con la consecuente pérdida de agudeza visual, y la ceguera nocturna. También produce la desecación de las membranas mucosas, así como el desarrollo y crecimiento retrasados.
Exceso: La ingestión de grandes cantidades de esta vitamina es tóxica y produce una serie de alteraciones, como ahogo, caída del pelo, debilidad…
La vitamina D engloba a una serie de esteroles: vitamina D2, D3, D4, D5 y D6. Las más conocidas son la vitamina D2 o calciferol y la vitamina D3 o colecalciferol, que se obtienen a partir de dos provitaminas: ergosterol y 7-deshidrocolesterol, respectivamente. Esta obtención tiene lugar mediante la acción de los rayos ultravioletas del Sol en la piel.
Fuentes; existen tres vías de obtención en el ser humano:
a) Por ingestión de ergosterol, provitamina de origen vegetal que se transforma en la piel en vitamina D2.
b) A partir del 7-deshidrocolesterol (derivado del colesterol), que es segregado por glándulas epidérmicas y que se transforma sobre la piel en vitamina D3, que es reabsorbida.
c) Por ingestión directa al tomar alimentos que la contengan, como arenque, salmón, sardina, extractos de hígado, leche y huevos.
Acción; favorece la absorción de Ca2+ a través de la pared intestinal, la concentración de Ca2+ en la sangre y su fijación en huesos y dientes.
Déficit; su falta origina el raquitismo en los niños y la osteomalacia en los adultos. Estas enfermedades producen una defectuosa calcificación de los huesos, que se ablandan y deforman.
Exceso. El consumo excesivo de esta vitamina provoca trastornos digestivos, con vómitos y diarreas, y calcificaciones de órganos como el riñón, hígado, corazón, etc.
Fuentes; se encuentra en alimentos de origen vegetal, sobre todo en los de hoja verde, en semillas, aceites vegetales, mantequilla y también en la yema de huevo.
Acción; protege a los lípidos de membrana su oxidación metabólica. Actúa como cofactor en la cadena de transporte electrónico.
Déficit; se ha comprobado que la hipovitaminosis produce, además de trastornos digestivos y reproductores, parálisis y distrofia muscular.
Exceso; su consumo excesivo no produce toxicidad.
Fuentes; es abundante en la coliflor. Como también la sintetizan las bacterias intestinales, no es imprescindible su ingestión en la dieta.
Acción; actúa en la formación de la protrombina, proceso que tiene lugar en el hígado. Esta molécula es la precursora de la trombina, enzima que transforma el fibrinógeno en fibrina, sustancia necesaria para la coagulación sanguínea.
Déficit; las carencias de vitamina K son raras y se deben a alteraciones en la absorción intestinal, generalmente causadas por déficit de ácidos biliares encargados de la absorción de lípidos en el intestino. La hipoavitaminosis favorece los trastornos en la coagulación sanguínea.
Exceso; no produce ningún trastorno.
Son solubles en agua, y por tanto se difunden muy bien por la sangre. Se trata de coenzimas o precursores de coenzimas, necesarias para muchas reacciones químicas del metabolismo.
El exceso de vitaminas ingeridas no produce trastornos, ya que se excreta fácilmente por la orina, por lo que se requiere una ingesta prácticamente diaria, porque como no se almacena, depende de la dieta. En este grupo se incluyen las vitaminas del complejo vitamínico B (vitaminas B1, B2, B3, B5, B6, B8, B9 y B12) y la vitamina C.
Fuentes. La producen muchas bacterias, hongos (levaduras) y vegetales y aparece con abundancia en las envueltas de cereales y legumbres. También en cerdos y vísceras.
Acción. Regula el metabolismo de los glúcidos. La forma difosfotiamina, transforma el ácido pirúvico en el grupo acetil, paso necesario en el ciclo de Krebs.
Déficit. Su carencia produce un cuadro de síntomas denominado beriberi, que se caracteriza por una degeneración de las neuronas (neuritis) y se manifiesta mediante debilidad muscular, falta de coordinación, hipersensibilidad, insuficiencia cardiaca, falta de apetito, edemas y, en casos extremos, la muerte.
Fuentes; aparece en casi todos los alimentos. Es producida por bacterias, levaduras y vegetales de color amarillo (con pigmentos como la antoxantina de color amarillo). También se encuentra en la leche, huevos, hígado…
Acción; forma parte del FAD (flavín-adenindinucleótido) y del FMN (flavín-mononucleótido). Ambos son coenzimas de enzimas deshidrogenasa que actúan en procesos respiratorios celulares, sobre todo en la oxidación de glúcidos y aminoácidos.
Déficit; su carencia origina alteraciones como el enrojecimiento e irritabilidad de labios, lengua, mejillas y ojos; éstos, además, acusan molestias frente a la luz (fotofobia).
Esta vitamina también es conocida con los nombres de ácido nicotínico o vitamina PP (preventiva de la pelagra). Una variante es la nicotinamida.
Fuentes; es producida por hongos, por lo que abunda en alimentos obtenido por fermentación con levadura. Los animales pueden sintetizarla a partir de triptófano. Es también abundante en la leche y en la carne.
Acción; forma parte del NAD (nicotín-adenín-dinucleótido) y del NADP (fosfato de NAD), que son coenzimas de enzimas encargadas de la deshidrogenación en los procesos de oxidación de glúcidos y prótidos.
Déficit; su carencia ocasiona la aparición de la pelagra, que se caracteriza por el enrojecimiento de la cavidad bucal, trastornos del aparato digestivo (con vómitos, diarreas y náuseas), aparición de piel áspera y de color oscuro en las zonas expuestas a la acción del sol. En casos graves se producen trastornos nerviosos y mentales (confusión, pérdida de memoria, depresión, alucinaciones, manías persecutorias…) y, en casos extremos, la muerte.
Exceso; es la única vitamina hidrosoluble que causa trastornos al ser ingerida en grandes cantidades. Estos trastornos son: sonrojo, quemazón y picores en la piel.
Fuentes; es sintetizado por bacterias, hongos (levaduras) y vegetales de hoja verde. Aparece en todos los tejidos animales, en donde se almacena.
Acción; forma parte de la coenzima A, que interviene en la formación y degradación de ácidos grasos y colesterol. También se conoce su actividad en gran número de reacciones metabólicas.
Déficit; su carencia produce dermatitis, despigmentación, anemia y retraso en el crecimiento.
Fuentes; es sintetizada por vegetales de hoja verde y por levaduras. Los animales la acumulan en el hígado, por lo que este órgano es rico en dicha vitamina.
Acción; actúan en la formación de niacina a partir del triptófano. Por tanto, sus síntomas carenciales se confunden con lo de esta vitamina. Además, el fosfato de piridoxina es una coenzima de enzimas reguladoras del metabolismo de los aminoácidos.
Déficit; su carencia provoca anemia, acompañada de alteraciones del sueño, irritabilidad y posibles trastornos mentales.
Fuentes; es producida por los vegetales y por las bacterias. Los animales obtienen la biotina por absorción a través de la pared intestinal, en donde la flora bacteriana también la produce.
Acción; actúa en reacciones de fijación de CO2 (carboxilaciones).
Déficit; su carencia origina palidez, dermatitis, dolores musculares y anemia.
Fuentes; aparece en un gran número de alimentos: hígado, riñón, alimentos producidos mediante fermentación con levadura, huevos, leche, semillas, vegetales verdes.
Acción; es una coenzima que, en unión con una apoenzima, está encargada de la transferencia de grupos monocarbonados. Se ha comprobado su actividad en la formación de purinas y pirimidinas. También se conoce su relación con los procesos de crecimiento y en la eritropoyesis (formación de glóbulos rojos).
Déficit; su carencia en los adultos provoca anemia y, en los niños, detención del crecimiento. Su deficiencia durante el embarazo produce malformaciones congénitas.
Se denomina cobalamina, pues tiene un anillo porfirínico asociado a un átomo de cobalto. Se conocen varios derivados de la vitamina B12 que son activos.
Fuentes; es producida por bacterias. Los animales la obtienen a nivel de la pared intestinal, ya que es producida por las bacterias intestinales. En carnes rojas, huevos y productos lácteos.
Acción; interviene en el metabolismo de formación de proteínas y ácidos nucleicos. Asimismo, actúa en la eritropoyesis.
Déficit; la falta de esta vitamina origina un tipo grave de anemia denominada perniciosa, debida a malformaciones de los glóbulos rojos.
Fuentes; los vegetales la sintetizan, al igual que gran número de animales. La vitamina C abunda en los cítricos, en las hortalizas y en la leche de vaca.
Acción; es un potente reductor mediante su oxidación en ácido deshidroascórbico. Se ha comprobado su actividad en la síntesis del colágeno, fibra que forma parte de los tejidos reticulares, encargados de mantener la cohesión de los tejidos.
Déficit; la carencia de la vitamina C provoca un cuadro de síntomas denominado escorbuto, caracterizado por hemorragias, encías sangrantes, caída de dientes y trastornos digestivos. Todo ello favorece la aparición de infecciones y, en casos graves, incluso la muerte.


























.jpg)












.jpg)






.jpg)




.jpg)



.jpg)






.jpg)





.jpg)




















.jpg)





















No hay comentarios:
Publicar un comentario