El funcionamiento integral de los organismos vivos está garantizado por unos mecanismos de defensa orgánica; de estos mecanismos se encarga el denominado sistema inmune.
La función de dicho sistema inmune consiste en reconocer todo lo que pertenece al propio organismo y diferenciarlo de los elementos extraños que pudieran invadirlo, con la única finalidad de destruir a estos últimos. Esto incluye a los microorganismos infecciosos pero también a cualquier partícula extraña o tejidos y órganos trasplantados.
Además el sistema inmune cumple una función de eliminación de células del propio organismo, lesionadas o enfermas, respetando a aquellas que se encuentran en buenas condiciones.
La respuesta defensiva la llevan a cabo células especializadas (leucocitos) y moléculas proteicas solubles (anticuerpos), cuya actuación se enmarca en la denominada respuesta inmune.
El sistema inmune alcanza su máximo desarrollo en los vertebrados y dentro de ellos es de máxima complejidad y eficacia en los mamíferos, orden al que pertenecemos los seres humanos.
La rama de la biología que se encarga del estudio de los procesos inmunes recibe el nombre de inmunología.
1. Los antígenos y el MHC
Las moléculas ajenas a un organismo, que son reconocidas como tales y que son capaces de desencadenar una respuesta del sistema inmune se denominan antígenos. Los antígenos son diferentes en los distintos seres vivos, una molécula que posee carácter antigénico para un organismo puede no tenerlo para otro al ser una molécula propia.
En la membrana plasmática de cada célula hay un conjunto de moléculas, glucoproteínas y glucolípidos, que son reconocidas por el sistema inmune como propias del organismo y no desencadenan la respuesta inmune (excepto en las enfermedades autoinmunes). Son las moléculas del llamado complejo principal de histocompatibilidad (MHC - “Major Histocompatibility Complex”). En un principio también fueron designadas como HLA ("Human Leucicyte Antigen") al estudiarse en la membrana de los leucocitos.
Los antígenos tienen las siguientes características:
a) Son moléculas de gran tamaño, principalmente polisacáridos complejos (como los dextranos) y proteínas (independientes o unidas a glúcidos o lípidos). Muchas moléculas sintéticas también actúan como antígenos.
b) Pueden ser moléculas libres o estar formando parte de determinadas estructuras biológicas (membrana plasmática, glicocálix, flagelos, pared y cápsulas bacterianas, cápsida y envuelta vírica, etc).
c) Ciertas moléculas de baja masa molecular (haptenos) pueden volverse antigénicas al unirse a proteínas del organismo en el que son introducidas. Esto ocurre en algunos antibióticos, como la penicilina, lo que puede causar reacciones alérgicas a estos medicamentos.
d) Para que el sistema inmunitario desencadene una respuesta cuando detecta la presencia de antígenos, es preciso que estos se reconozcan como tales. Si esto no se produce, la molécula extraña al organismo no se puede considerar un antígeno.
Este reconocimiento se produce mediante la unión selectiva de los antígenos con ciertas moléculas (receptores del antígeno) situadas en la membrana plasmática de algunas células del organismo.
Se trata de una identificación de tipo estructural, es decir, existe una complementariedad entre la forma espacial de estos receptores y la de los antígenos correspondientes y altamente específica. El antígeno no se une al receptor del antígeno en su totalidad, sino por una zona llamada epítopo o determinante antigénico que suele estar constituida por una corta secuencia de aminoácidos (4-5). Las moléculas antigénicas tienen muchos epítopos, iguales o distintos entre sí.
Dependiendo del número de determinantes que presente los antígenos se denominan monovalentes, si presentan uno; divalentes, si presentan dos y polivalentes, si presentan muchos.
Respecto a la procedencia de los antígenos estos pueden clasificarse de la siguiente manera:
a) Xenoantígenos, cuando proceden de otras especies distintas que la del receptor, por ejemplo una bacteria.
b) Aloantígeno, cuando proceden de individuos de la misma especie que la del receptor, por ejemplo los glóbulos rojos de otra persona.
c) Autoantígenos, si pertenecen al mismo individuo. Es obvio que el carácter de autoantígenos se debe a alguna anormalidad, por ejemplo las células cancerosas.
Los antígenos proteicos pueden ser empleados para dilucidar parentescos evolutivos, sobre todo entre microorganismos. Especies muy alejadas entre sí poseen antígenos muy distintos. Lo contrario ocurre con especies que proceden de un antepasado común reciente.
También se emplea mucho el estudio de las características antigénicas de distintas cepas de un mismo microorganismo para establecer su capacidad patógena.
2. Mecanismos de defensa del organismo
Los mecanismos de defensa se agrupan tradicionalmente en dos grandes grupos:
a) Mecanismos inespecíficos o no inducibles; son aquellos que:
· no dependen de la naturaleza o identidad del agente infectante.
· no es necesario un contacto previo con el patógeno para desencadenarse.
· su acción es inmediata.
· carecen de memoria inmunológica.
b) Mecanismos específicos o inducibles; son aquellos que:
· sí dependen de la naturaleza o identidad del agente infectante.
· se da una respuesta específica contra los agentes patógenos y los antígenos.
· su acción se desencadena después de un contacto previo con el patógeno.
· tienen memoria inmunológica.
3. Mecanismos de defensa inespecíficos
Podemos destacar dos grandes tipos de defensas inespecíficas:
a) Barreras (físicas, mecánicas, químicas, microbiológicas); encargadas de intentar evitar la entrada de los microorganismos.
b) Defensas internas inespecíficas o sistema inmunitario innato (las defensas inespecíficas celulares y humorales, la fagocitosis y la respuesta inflamatoria). Son las encargadas de intentar eliminar a los microorganismos que superan las barreras.
3.1 Barreras pasivas/primarias o defensas externas
Estas barreras tratan de impedir la penetración de los microbios de un modo pasivo. Existen cuatro tipos de defensas externas que pueden actuar conjuntamente:
A) BARRERAS FÍSICAS; las barreras físicas son la piel (endurecida por queratina) y las mucosas que recubren el cuerpo y las cavidades de los aparatos que comunican con el exterior. Los microorganismos aprovechan la rotura de estas barreras (por heridas, ulceraciones,...) para penetrar en el interior del organismo.
La piel es la primera defensa del cuerpo ante la entrada de cualquier microorganismo. La piel es seca debido a la queratina, pero la piel no queratinizada como la de la boca, los orificios nasales o el ano, cambia de aspecto y se llama mucosa. Las células de las mucosas secretan mucus y por eso están húmedas. El mucus fija e inmoviliza a muchos microorganismos, impidiendo que éstos penetren.
B) BARRERAS MECÁNICAS; Las barreras mecánicas impiden de forma mecánica e inespecífica el paso de microorganismos. Son sistemas de expulsión que permiten el arrastre de los microorganismos y otras partículas extrañas para evitar que penetren en el organismo. Por ejemplo, los cilios de las células epiteliales de las vías respiratorias, cuyo movimiento elimina los microorganismos y otros elementos extraños existentes en el mucus que los cubre. También, el flujo de orina desde la vejiga urinaria hacia el exterior, las lágrimas, y el movimiento intestinal también favorecen el arrastre y la expulsión de microorganismos.
C) BARRERAS QUÍMICAS; algunas secreciones actúan como barrera química contra los gérmenes. Algunos ejemplos de este tipo de barreras son:
· La saliva, lágrimas y la mucosidad buconasal producen la enzima lisozima, que destruye la pared bacteriana. De este modo, las aberturas naturales de nuestro cuerpo (boca, ojos y orificios nasales) que carecen de queratina y están recubiertas por mucosas, están protegidas.
· La piel, además de impedir que penetren microorganismos entre sus células, contiene glándulas sebáceas que producen ácidos grasos y ácido láctico que hacen descender el pH, impidiendo que se desarrollen muchos microorganismos.
·
El estómago, con el ácido clorhídrico
del jugo gástrico, protege el estómago de los microorganismos que
pueden contener los alimentos![]() .
.
· El epitelio vaginal también produce secreciones ácidas que impiden el desarrollo de los microorganismos.
D) BARRERAS MICROBIOLÓGICAS; la microbiota bacteriana autóctona que habita como comensal o en simbiosis en la piel y en los aparatos digestivo y urogenital, produce sustancias que impiden la proliferación de otros microorganismos (potencialmente patógenos), además de competir con ellos por los nutrientes y el medio.
3.2 Barreras secundarias o defensas internas
Como ya hemos visto, si las barreras externas son superadas, actúa un segundo sistema de barreras internas inespecíficas. Estas barreras secundarias constituyen el sistema inmunitario innato, presente en todos los seres vivos, inespecífico, de respuesta rápida y que no cuenta con memoria inmunológica.
3.2.1 Componentes de las barreras secundarias internas
La segunda barrera de defensa del organismos está compuesta por dos tipos de componentes inespecíficos: celulares y humorales o moleculares.
3.2.1.1. COMPONENTES CELULARES INESPECÍFICOS
Las células que forman parte de esta barrera secundaria son:
a) Granulocitos (o leucocitos polimorfonucleares): leucocitos caracterizados por tener numerosos gránulos en el citoplasma y un núcleo polilobulado. En dichos gránulos almacenan enzimas y compuestos químicos antimicrobianos y según con el colorante que se tiñan se clasifican en: Neutrófilos, Eosinófilos y Basófilos.
b) Monocitos: leucocitos agranulocitos y sin núcleo polilobulado que circulan por el torrente sanguíneo y se dirigen a los tejidos lesionados, donde se convierten en macrófagos, que fagocitan al agente patógeno y actúan como células presentadoras de antígenos.
Pueden desplazarse libremente en los tejidos o permanecer fijos convirtiéndose en histiocitos. Estos aparecen en todos los tejidos pero especialmente en las zonas más vulnerables a una infección como los alveolos pulmonares, la piel (células de Langerhans), el hígado (células de Kupffer), el bazo formando el sistema reticuloendotelial.
c) Mastocitos o células cebadas: células del tejido conectivo que contienen gránulos de histamina y heparina. Intervienen en procesos inflamatorios y alérgicos.
d) Células NK o “Natural Killer”; linfocitos encargados de destruir las células infectadas por virus, las células cancerosas y las células de órganos trasplantados. No son células fagocíticas.
3.2.1.2. COMPONENTES HUMORALES/MOLECULARES INESPECÍFICOS
También hay otros componentes moleculares inespecíficos de esta barrera secundaria defensiva, que están disueltos en el plasma sanguíneo:
A) Interferón: es un conjunto de proteínas producidas por las células que han sido infectadas por un virus, bacterias, parásitos y por células tumorales. Interviene de manera inespecífica y específica.
· Activa las defensas en las células cercanas, activando las células NK y a los macrófagos y aumentando la presentación del antígeno, ya que aumenta la expresión de los antígenos del complejo mayor de histocompatibilidad (MHC).
· Si la célula está infectada por un virus, se unen a receptores de la membrana de la célula infectada impidiendo la replicación del virus mediante la síntesis de una enzimas llamadas proteínas antivíricas o AVP (antivirus protein). Además, aumenta la resistencia de las células sanas a la infección por virus.
El interferón actúa, por lo tanto, en dos niveles: por un lado, evita la replicación del virus en células aun sanas y, por otro, favorece la destrucción de las células ya infectadas por el virus impidiendo que produzcan más.
También va a participar en la defensa específica activando los linfocitos B y modulando la síntesis de anticuerpos y linfocinas.
El interferón es menos efectivo ante virus muy virulentos que inhiben la síntesis proteica de la célula infectada antes de que esta haya podido producir las AVP.
El interferón protege frente a todos los virus que infectan un organismo pero es específico de este (no sirve en otras especies). La obtención de interferón humano con fines médicos era muy cara, dada la pequeñísima cantidad que hay en el organismo pero usando técnicas de ingeniería genética se consiguió su producción masiva, lo que ha abaratado muchísimo su obtención y ha posibilitado un uso mayor.
B) Sistema del complemento: es un conjunto de proteínas plasmáticas producidas en el hígado, cuya función directa es el reconocimiento y destrucción de los patógenos cuando éstos invaden nuestro organismo. Si no hay antígenos, estas proteínas están inactivas. Pero la presencia de las moléculas de la superficie bacteriana o de antígenos unidos a anticuerpos, provoca una activación en cascada bioquímica, en la que unas proteínas activan a otras.
La activación del complemento se realiza de dos formas:
· Vía clásica: forma parte de la respuesta inmunitaria adaptativa, por lo que es un tipo de defensa específica. Se activa cuando los anticuerpos se unen a los antígenos que recubren la superficie de los microrganismos patógenos.
· Vía alternativa: forma parte de la respuesta inmunitaria innata. Se trata de un tipo de defensa inespecífica. Se produce por la presencia de estructuras extrañas de las envolturas celulares microbianas (independiente de los complejos antígeno-anticuerpo).
El componente C3b, además de su función como opsonina, desencadena el proceso llamado vía terminal del complemento que termina formando un complejo proteico que se adhiere a la cubierta del patógeno formando un canal que la perfora y provocando la lisis celular.
La activación del complemento facilita:
- La acción de los fagocitos mediante la opsonización (marcaje de la célula a fagocitar por las opsoninas).
- La lisis de células patógenas.
- La generación de la respuesta inflamatoria, estimulando los mastocitos para que liberen histamina. Es un mediador de la inflamación.
C) Citoquinas o citocinas; son proteínas que regulan la función de las células que las producen sobre otros tipos celulares. Regulan, coordinan y potencian la respuesta inmunitaria. Por ejemplo, las interleucinas, sintetizadas por los leucocitos, que inducen su crecimiento y diferenciación.
3.2.2 Mecanismos de las barreras secundarias internas
Podemos destacar dos mecanismos fundamentales: la respuesta inflamatoria y la fagocitosis.
3.2.2.1. RESPUESTA INFLAMATORIA
Cuando una estructura extraña consigue atravesar las barreras pasivas de un ser vivo, el organismo invadido reacciona rápidamente poniendo en marcha la respuesta inflamatoria que, a su vez, activa y coordina las otras defensas inespecíficas. El proceso inflamatorio es un sistema muy eficaz para preparar los mecanismos de respuesta que se desencadenarán al penetrar en el organismo un antígeno invasor.
La inflamación tiene unos síntomas característicos llamados tétrada de Celso:
a) Tumefacción; aumenta el líquido intersticial y se forma un edema.
b) Rubor; enrojecimiento de la zona producido por la vasodilatación.
c) Calor; la vasodilatación y el consumo local de oxígeno produce un aumento de la temperatura de la zona inflamada.
d) Dolor; aparece como consecuencia de la liberación de sustancias capaces de provocar la activación de los nociceptores, tales como las prostaglandinas.
La respuesta inflamatoria se lleva a cabo en cuatro etapas:
1. Producción de un estímulo, que habitualmente consiste en la entrada de un microorganismo o de una sustancia tóxica, aunque también puede deberse a un traumatismo.
2. Liberación de mediadores de la inflamación; las células lesionadas liberan estas sustancias, entre las que destacan:
· Factor de estimulación de la leucocitosis; incrementa el número de fagocitos circulantes al estimular su liberación a partir de la médula ósea.
· Leucotrienos; producen una atracción (quimiotaxis) sobre los fagocitos (leucocitos con capacidad de fagocitar) y aumentan la permeabilidad de los vasos sanguíneos.
· Histamina y bradiquinina; son vasodilatadores que aumentan también la permeabilidad capilar. También estimulan las terminaciones nerviosas, provocando la sensación de dolor.
· Prostaglandinas E; son sustancias que producen una vasodilatación prolongada y atraen y activan a los fagocitos. Por otra parte, aumentan la sensibilidad de los receptores del dolor a la histamina y la bradiquinina.
También actúan como mediadores de la inflamación:
· Los componentes del complemento; se trata de ciertas proteínas del plasma sanguíneo (C3a y C5a), que provocan vasodilatación y atraen y activan a los fagocitos.
· Productos bacterianos; las sustancias procedentes del metabolismo de las bacterias y las moléculas liberadas cuando son destruidas atraen y activan a los fagocitos.
3. Estos mediadores de la inflamación actúan sobre los capilares de la zona causando los siguientes efectos:
· Aumento de la cantidad de leucocitos circulantes en la sangre.
· Vasodilatación.
· Aumento de la permeabilidad capilar.
· Activación y quimiotactismo de los fagocitos.
4. Aparición de las consecuencias de los efectos anteriores:
· La presencia de un número mayor de leucocitos produce un aumento de las acciones defensivas que estas células llevan a cabo.
· La vasodilatación incrementa el riego sanguíneo de la zona afectada y la afluencia de elementos defensivos, tanto leucocitos como moléculas de anticuerpos y del complemento.
· El aumento de la permeabilidad de los capilares favorece la salida de fagocitos, anticuerpos, complemento y fibrinógeno hacia los tejidos infectados. La salida de los fagocitos de los capilares sanguíneos se consigue mediante la separación de las células endoteliales que los forman (diapédesis).
El fibrinógeno extravasado coagula y produce un aislamiento de la zona lesionada que dificulta la diseminación del agente invasor. A esto también van a contribuir los trombocitos.
· La activación de los fagocitos hace que sean más eficaces en la eliminación de los microorganismos invasores.
· El quimiotactismo resulta esencial para localizar el lugar de infección y atraer hacia él a una gran cantidad de fagocitos.
· Al
fagocitar los gérmenes, muchos fagocitos mueren formando el “pus”.
El pus es un líquido espeso de color amarillento o blanquecino
formado por una mezcla de suero sanguíneo, bacterias muertas,
leucocitos muertos (después de fagocitar grandes cantidades
de bacterias), células dañadas y sustancias extrañas![]() .
.
3.2.2.2. FAGOCITOSIS
Si el patógeno supera las barreras primarias, se encuentran con los fagocitos, un tipo de leucocitos que forman la segunda barrera defensiva.
Los fagocitos son células con capacidad fagocitaria no específica que, mediante pseudópodos, engloban microorganismos y células inservibles, formando el fagosoma, para digerirlos después en sus lisosomas.
Como ya hemos estudiado, existen dos tipos diferentes de fagocitos:
a) Los micrófagos o leucocitos neutrófilos son los fagocitos más abundantes. Llegan al lugar donde se ha producido la infección por diapédesis, a través de las paredes de los capilares sanguíneos hasta llegar a los tejidos y fagocitar a los microorganismos patógenos.
b) Los monocitos, un tipo de leucocitos que, tras pasar varios días en la sangre, se desplazan a diferentes tejidos (del hígado, bazo, pulmones, médula ósea,...) y se transforman en macrófagos, células más grandes y con mayor capacidad fagocítica. Los macrófagos pueden desplazarse o permanecer fijos (si permanecen fijos se llaman histiocitos). Los macrófagos son los principales constituyentes del sistema reticuloendotelial.
Para que la fagocitosis sea eficaz es necesaria una activación previa de los fagocitos, lo cuál se consigue, como hemos visto, gracias a los mediadores de la inflamación (protaglandinas, componentes del complemento y productos bacterianos. También contribuyen a la activación determinadas sustancias producidas por los linfocitos.
La activación consiste en la producción de moléculas glucoproteícas en la membrana celular del fagocito que incrementan su capacidad de adhesión a cualquier estructura extraña.
Los primeros fagocitos en actuar son, generalmente, los histiocitos que se encuentran en el propio tejido invadido.
Sin embargo, su capacidad fagocítica no es muy grande y enseguida comienza la acción de los neutrófilos sanguíneos, procedentes de los capilares, que tienen una vida corta (dos o tras días) y actúan en infecciones agudas.
Posteriormente acuden macrófagos libres con mayor actividad fagocítica aún (mientras que un neutrófilo puede fagocitar entre 5-25 microorganismos antes de morir, un macrófago puede eliminar hasta cien de ellos).
El proceso fagocítico se divide en cuatro etapas:
a) Unión al elemento que va a ser fagocitado mediante receptores glucoproteicos de la membrana. Esta unión se ve favorecida por la presencia de unas moléculas llamadas opsoninas, que sirven de puentes moleculares entre los receptores del fagocito y la pared bacteriana y facilitan el proceso de fagocitosis. Por lo tanto, que los microorganismos estén recubiertos previamente de opsoninas (microorganismos opsonizados) facilita que sean fagocitadas.
Las opsoninas más importantes son los anticuerpos y ciertos componentes del complemento que se han unido a los antígenos superficiales del microorganismo al detectarse su presencia.
b) Ingestión por medio de la emisión de pseudópodos. Cuando dos pseudópodos se unen dan lugar a un fagosoma en el que la estructura fagocitada queda encerrada.
c) Muerte y digestión intracelular del microorganismo por la acción de las enzimas digestivas y oxidantes de los lisosomas, como la lisozima, que se liberan en el fagosoma, el cual pasa entonces a formar el fagolisosoma.
d) Expulsión de los restos no digeridos por exocitosis.
La fagocitosis se realiza mucho más eficientemente cuando se lleva a cabo contra una superficie, como la pared de un vaso sanguíneo o un coágulo de fibrina.
El conjunto de restos bacterianos, fagocitos y otras células muertas constituye el pus.
Como ya hemos estudiado, algunos microorganismos han desarrollado estrategias para resistir la fagocitosis lo que hace que sus infecciones sean más difíciles de combatir. Por ejemplo con cápsulas protectoras (Streptococcus pneumoniae) o con la capacidad de sobrevivir e incluso reproducirse dentro de los propios fagocitos (Mycobacterium tuberculosis).
Además de la fagocitosis propiamente dicha, los fagocitos van a realizar tres funciones secundarias:
a) Liberación de productos tóxicos para los microorganismos localizados en su cercanía. Los eosinófilos son los encargados de realizar este proceso, llamado desgranulación, esencial para combatir los agentes patógenos que, debido a su gran tamaño, no pueden ser fagocitados (como los parásitos).
b) Algunos leucocitos, como los basófilos y mastocitos derivados de estos, liberan histamina, un mediador de la inflamación.
c) Los macrófagos cooperan con los linfocitos, produciendo un conjunto de sustancias que los activan, y favorecen el reconocimiento e identificación de los distintos antígenos. Hay una interrelación entre las defensas inespecíficas y específicas.
3.2.2.3. LA FIEBRE
A menudo, los procesos infecciosos van acompañados de fiebre. Esta alteración consiste en una elevación de la temperatura corporal debida a un desajuste del centro termorregulador del hipotálamo.
El origen de la fiebre radica, por regla general, en la presencia de pirógenos exógenos. Estos son sustancias producidas por ciertos microorganismos que hacen que los macrófagos liberen una sustancia pirógena endógena (interleucina 1), que actúa sobre el centro regulador hipotalámico. Algunas toxinas bacterianas tienen un potente efecto pirógeno, incluso en cantidades mínimas.
La elevación de la temperatura corporal provoca los síntomas conocidos de la fiebre: escalofríos, temblores y sensación de calor.
La fiebre contribuye a combatir de forma más eficaz a los microorganismos produciendo:
a) la actividad de los fagocitos y de los linfocitos es mayor al aumentar la temperatura (38-40 ºC).
b) algunos microorganismos crecen más lentamente a temperaturas superiores a 37 ºC.
c) disminuye la concentración de hierro en la sangre, dificultando el crecimiento de las bacterias.
Cuando la fiebre es muy elevada puede ser peligrosa y debe bajarse usando medicamentos antipiréticos. También pueden usarse para paliar los síntomas desagradables que provoca la misma.
4. Mecanismos de defensa específicos
Si las barreras primarias (físicas, mecánicas, químicas y microbiológicas) y las secundarias (fagocitos) son superadas, los microorganismos pueden extenderse por todo el cuerpo generalizando la infección.
El sistema inmunitario adaptativo es la tercera barrera defensiva del organismo y es más potente que la fagocitosis. Esta respuesta es específica, sólo actúa contra el agente patógeno identificado (por los antígenos de superficie) y lo elimina.
Otra característica de esta respuesta es que tiene memoria inmunológica. El sistema inmunitario produce linfocitos de memoria que recuerdan cada antígeno después de su primer contacto (respuesta primaria). Si se vuelve a producir otro contacto posteriormente con ese antígeno, la respuesta (respuesta secundaria) es mucho más rápida e intensa.
Una persona es inmune a una determinada enfermedad infecciosa cuando es invulnerable a dicha enfermedad. Antiguamente ya se sabía que personas que habían padecido y superado alguna infección, se volvían inmunes a esa enfermedad y no volvían a tener esa enfermedad.
El sistema inmunitario presenta tolerancia inmunológica, por eso puede distinguir las moléculas propias de las ajenas y no ataca a las células de los tejidos del organismo. A veces se producen fallos y causan enfermedades autoinmunes.
4.1 Componentes del sistema inmunitario
El sistema inmunitario está formado por el conjunto de células y moléculas que intervienen en la inmunización del organismo. La principal característica del sistema inmunitario es la capacidad de reconocer antígenos (moléculas extrañas al organismo) y eliminarlas.
Podemos destacar los siguientes componentes: órganos linfoides, células inmunocompetentes, antígenos y anticuerpos.
4.1.1 Linfocitos
Los linfocitos son un tipo de leucocitos que se encuentran en la sangre y en la linfa. Su núcleo es grande y redondeado, y tiene poco citoplasma. No pueden formar pseudópodos y, por tanto, no fagocitan. Su función principal es la de regular la respuesta inmunitaria específica (o adaptativa), reaccionando frente a materiales extraños (microorganismos, células tumorales o antígenos en general).
Existen los siguientes tipos de linfocitos:
a) Linfocitos B; se desarrollan y maduran en la médula ósea y luego migran a diferentes tejidos linfáticos. Son los encargados de la respuesta inmunitaria humoral, transformándose en células plasmáticas o plasmocitos que producen anticuerpos (proteínas específicas) ante la presencia de antígenos.
b) Linfocitos T; se forman en la médula ósea y se desarrollan en el timo y participan en la respuesta inmunitaria celular. No producen anticuerpos, sino que provocan la muerte de ciertas células alteradas y, por tanto, no deseadas. Hay tres tipos de linfocitos T:
· Linfocitos T citotóxicos (Tc). Reconocen a los antígenos que están unidos a las células del organismo, y las destruyen, actuando sobre células infectadas por virus o células tumorales. Tienen receptores CD8+
· Linfocitos T colaboradores o cooperadores (Th). Reconocen las células presentadoras del antígeno y activan los linfocitos B. Tienen receptores CD4+.Presentan dos subpoblaciones:
- Tipo Th1: promueven la respuesta inmunitaria celular: activan a los macrófagos y a los linfocitos Tc.
- Tipo Th2: promueven la respuesta inmunitaria humoral: producen interleucinas que transforman a los linfocitos B en células plasmáticas (productoras de anticuerpos).
· Linfocitos T reguladores o supresores (Ts). Suprimen la respuesta autoinmune que puede destruir las células su propio cuerpo, actúan al final de la respuesta inmunitaria. Tienen receptores CD4+
c) Linfocitos no-B no-T; también destruyen células diana, pero de una forma inespecífica. Por eso ya los mencionamos en el punto anterior.
4.1.2 Órganos linfoides
Además de las células defensivas, descritas anteriormente, existen una serie de órganos, denominados órganos linfoides, que están relacionados con la formación, maduración y acumulación de linfocitos. Los órganos linfoides se clasifican en dos grupos, denominados primarios y secundarios respectivamente:
4.1.2.1. Órganos linfoides primarios
Son aquellos en los que se originan los linfocitos y en los que se produce la maduración definitiva de estos. Son los siguientes:
a) La médula ósea roja, donde se localizan las células madre que originan todas las células sanguíneas, entre ellas los linfocitos
b) El timo, glándula en la que se lleva a cabo la maduración de los linfocitos T.
4.1.2.2. Órganos linfoides secundarios
Reciben este nombre una serie de órganos en los que se produce una concentración de linfocitos y donde se lleva a cabo una maduración final de estos. Son los siguientes:
a) El bazo, órgano muy vascularizado situado en la cavidad abdominal, en el extremo posterior del páncreas.
b) Los ganglios linfáticos, situados a lo largo del sistema linfático, en el que se concentran de manera más abundante en las regiones inguinal, axilar, cervical y subclaviar.
c) Estructuras linfoepiteliales, asociadas a folículos linfáticos y epitelios de revestimiento de la cavidad interna donde se encuentran, tales como amígdalas, placas de Peyer, situadas en el intestino delgado, y el apéndice vermiforme, localizado en el ciego del intestino grueso. La inflamación de estos órganos es una señal de que se está produciendo una actividad propia de la reacción inmune, asociada normalmente a una infección.
4.1.3 Anticuerpos
Los anticuerpos son proteínas globulares (inmunoglobulinas o gammaglobulinas), con una pequeña parte glucídica, liberadas a la sangre por las células plasmáticas, es decir por los linfocitos B evolucionados y especializados, tras haber actuado sobre ellos un antígeno, y que tienen la particularidad de unirse específicamente con ese antígeno. Cada anticuerpo es específico para un único antígeno.
Su estructura química es la siguiente. Están formados por cuatro cadenas polipeptídicas unidas por puentes disulfuro con forma de Y. De estas cuatro cadenas dos son más largas y pesadas y reciben el nombre de cadenas H y las otras dos son más cortas y ligeras y reciben el nombre de cadenas L.
Las dos cadenas ligeras L son idénticas y presentan unos doscientos aminoácidos cada una. Las dos cadenas pesadas H también son idénticas, presentan unos cuatrocientos aminoácidos cada una.
Las cadenas se mantienen unidas por uniones no covalentes y covalentes (puentes disulfuro), y poseen dos tipos de regiones:
a) Región constante: los aminoácidos que la forman son iguales en cada tipo de anticuerpo pero diferente entre ellos. Por eso caracterizan la clase o tipo de inmunoglobulina (Ig) y constituyen el isotipo de un anticuerpo.
Está región es la encargada de la unión a la propia membrana de los linfocitos B, a los fagocitos o al complemento, según los casos. Está constituida por una parte de las cadenas ligeras y pesadas (pie y zona inferior de los "brazos de la Y").
b) Región variable: Es diferente en cada anticuerpo específico y se encuentra en el extremo opuesto de las cadenas pesadas y ligeras, o sea en los extremos de los "brazos de la Y" (extremo N-terminal). En este lugar se encuentra el sitio de unión al antígeno, por el epítopo de este, o paratopo. El conjunto de determinantes singulares o idiotopos de los dominios variables constituyen el idiotipo del anticuerpo.
Cada molécula de anticuerpo puede unirse a dos moléculas de antígeno (valencia 2). Algunos tipos de anticuerpos pueden asociarse aumentando de esta manera el número de moléculas de antígeno a los que pueden unirse.
La parte glucídica del anticuerpo se halla unida covalentemente a la región constante. Su función no está clara y se cree que puede intervenir en los procesos de secreción del anticuerpo o en protegerlo frente a ataques enzimáticos.
Los anticuerpos se localizan en la sangre, en muchas secreciones corporales (mucus, saliva, leche), en los líquidos intersticiales y en la membrana de los linfocitos B.
4.1.3.1. Tipos de anticuerpos
Según la composición y la estructura de las cadenas peptídicas, su localización y su función, se distinguen cinco clases de anticuerpos:
a) Inmunoglobulinas G (IgG) o gammaglobulinas. Son las más abundantes en la sangre (hasta el 85%) Son monoméricas y se localizan en la sangre y en los líquidos extracelulares.
Favorecen la fagocitosis, pues actúan como opsoninas al unirse a los antígenos situados en la superficie de las estructuras microbianas. Funcionan como antitoxinas, ya que neutralizan las exotoxinas al unirse a ellas.
Las IgG son las inmunoglobulinas más abundantes en la respuesta inmunitaria secundaria, que se produce siempre que se detecta un antígeno con el que ya ha existido un contacto previo.
Atraviesan la placenta materna, por lo que inmunizan al feto contra los antígenos para los que la madre gestante es inmune. También están en la leche materna y pueden atravesar las células intestinales del recién nacido protegiéndole con una inmunidad pasiva.
b) Inmunoglobulinas A (IgA). Pueden ser monoméricas (sangre y plasma intersticial) o diméricas (secreciones como la saliva, lágrimas, leche, mucus). En el segundo caso, la IgA, denominada IgA secretora, se une a un componente segregado por las células epiteliales. Su función básica consiste en proteger las mucosas de la invasión microbiana. Esta acción es fundamental para evitar la fijación de los virus, pues las IgA se unen a los lugares de la cápsida del virus por los que estos se adhieren a las células del hospedador.
c) Inmunoglobulinas M (IgM). Son pentaméricas y se encuentran en la sangre y los líquidos extracelulares, así como sobre la superficie de los linfocitos B, donde reconocen a los antígenos. Son muy eficaces en la activación del complemento y provocan, además, la precipitación de antígenos solubles.
Las IgM son los primeros anticuerpos que se producen tras la primera exposición a un antígeno nuevo (respuesta inmunitaria primaria).
d) Inmunoglobulinas D (IgD). Son monoméricas. Se localizan en la membrana de los linfocitos B, por lo que participan en el reconocimiento de los antígenos y en la estimulación de la producción de otros anticuerpos.
e) Inmunoglobulinas E (IgE). También aparecen como monómeros. Pueden encontrarse en la sangre y en los líquidos extracelulares.
Al unirse a la membrana de los leucocitos eosinófilos provocan su desgranulación, es decir, la secreción de enzimas digestivas y de otras moléculas que actúan sobre estructuras que no pueden ser fagocitadas debido a su gran tamaño (parásitos, por ejemplo).
Se unen, asimismo, a los basófilos y a los mastocitos, lo que causa también su desgranulación. Como consecuencia, se producen alteraciones no deseadas (procesos alérgicos).
4.1.3.2. Funciones de los anticuerpos
En general los anticuerpos actúan en las infecciones uniéndose a los antígenos, lo que pueden hacer de varias formas distintas:
a) Provocan la aglutinación de los antígenos cuando estos se encuentran en la superficie de las células, facilitando posteriormente la fagocitosis, que es llevada a cabo por los leucocitos fagocitarios.
b) Estimular el proceso de opsonización, es decir el recubrimiento de los gérmenes patógenos por anticuerpos para facilitar su fagocitosis por parte de los macrófagos o los fagocitos polimorfonucleares.
c) Neutralizar microorganismos y sus toxinas. Se lleva a cabo mediante la unión específica del anticuerpo a las porciones del antígeno implicadas en los mecanismos patogénicos.
d) Precipitar las moléculas de antígenos que están disueltas en los líquidos corporales, formando un complejo antígeno-anticuerpo que al hacerse grande pierde su solubilidad y precipita.
e) Matar bacterias mediante la activación de las proteínas del complemento presentes en el suero.
4.1.4 Citocinas
Como ya mencionamos en la respuesta inespecífica, reciben este nombre una serie de sustancias de carácter proteico que son sintetizadas y liberadas por diversos tipos de leucocitos y que tienen la función de amplificar y coordinar la respuesta contra los antígenos llevada a cabo por células inmunocompetentes.
A diferencia de los anticuerpos, las citocinas no son específicas de cada antígeno, pero intervienen en la reacción específica, razón por la también se incluyen en este apartado.
Se conocen dos tipos de citocinas, las denominadas linfocinas, segregadas por los linfocitos, y las monocinas, segregadas por los monocitos. Algunas de ellas reciben el nombre genérico de interleucinas, por su acción de relación e intercomunicación de determinados leucocitos.
4.1.5 Sistema MHC/HLA
Como ya dijimos al principio del tema, con este nombre HLA (Human Leucocyte Antigen) se designan una serie de antígenos localizados en un principio en los leucocitos y que posteriormente se ha visto que están presentes en las membranas de todas las células. Debido a ello también se conocen con el nombre de sistema MHC (Complejo Mayor de Histocompatibilidad).
Los antígenos del sistema HLA son de dos clases:
a) Clase I: son antígenos que se localizan en las membranas de todas las células del cuerpo.
b) Clase II: son antígenos que se localizan en las membranas de las células del sistema inmunitario.
En ambos casos son de naturaleza glucoproteica y juegan una importante función en los procesos de reconocimiento de células del propio organismo y demás reacciones de inmunidad.
4.2 Mecanismo de acción de la respuesta
inmune o inmunidad específica
La respuesta inmunitaria específica engloba un conjunto de procesos muy complejos en los que participan varios tipos de células y sustancias. Entre ellos se establecen numerosas relaciones, de manera que todos estos componentes intervienen de forma directa o indirecta en el resultado final.
A pesar de su complejidad, la respuesta inmunitaria específica se desarrolla siempre a lo largo de las siguientes fases:
1. Identificación y reconocimiento del antígeno extraño. El primer paso para poner en funcionamiento la maquinaria defensiva específica del organismo es detectar la presencia de sustancias extrañas a él, que se realiza mediante el contacto de los antígenos con determinadas moléculas existentes en la membrana de los linfocitos. Estas moléculas son anticuerpos en el caso de los linfocitos B y moléculas denominadas receptores de antígenos (TCR) en el caso de los linfocitos T.
El mecanismo de identificación consiste en un acoplamiento espacial entre los determinantes antigénicos y los receptores de los linfocitos; se trata, por tanto, de un reconocimiento morfológico entre ambas moléculas.
Aunque en algunos casos los antígenos pueden ser reconocidos directamente, lo habitual es que sea necesaria la intervención de las llamadas células presentadoras de antígenos, que fagocitan estructuras antigénicas y, tras su digestión intracelular, sitúan determinados fragmentos de los antígenos en su superficie. Estas células se dirigen entonces a los órganos linfoides, donde se encuentran los linfocitos. De esta forma, los antígenos son «presentados» a estos linfocitos para un reconocimiento más rápido y eficaz.
2. Activación de los linfocitos. Tras el reconocimiento del antígeno, los linfocitos sufren unos cambios metabólicos y fisiológicos, y comienzan a dividirse activamente. Se produce entonces un importante aumento en el número de linfocitos y se pone en marcha una serie de mecanismos para activarlos. En esta activación también participan los macrófagos.
3. Desencadenamiento de la respuesta inmunitaria. Una vez activados, los linfocitos llevan a cabo su función defensiva. Los linfocitos B se transforman en las llamadas células plasmáticas, que producen gran cantidad de anticuerpos específicos contra el antígeno correspondiente. Los linfocitos T, por su parte, atacan a las células portadoras del antígeno (células diana) y causan su destrucción. La respuesta inmunitaria debe estar perfectamente regulada para evitar una actuación defensiva deficitaria o excesiva, lo que se consigue mediante la acción de otros tipos de linfocitos T.
Los protagonistas de esta respuesta inmunitaria específica son un tipo de leucocitos de los que no hemos hablado apenas en la respuesta inespecífica: los linfocitos. Van a realizar esta respuesta de dos maneras:
a) Respuesta celular; actuando de forma directa contra el microorganismo (linfocitos T).
b) Respuesta humoral; actuando de forma indirecta contra el microorganismo, mediante los anticuerpos sintetizados por los linfocitos B.
4.3 Inmunidad humoral
Se denomina inmunidad humoral al conjunto de mecanismos inmunitarios en los que intervienen proteínas específicas fabricadas contra los antígenos extraños, los anticuerpos, que se difunden por los fluidos del organismo.
La síntesis de los anticuerpos se realiza por los linfocitos B.
4.3.1 Linfocitos B
Los linfocitos B se forman y diferencian en la médula ósea (de ahí la B → "bone"). Allí adquieren capacidad para producir anticuerpos, moléculas específicas contra los antígenos invasores. Por esta razón se dice que son células inmunocompetentes.
En la médula ósea se generan millones de linfocitos B, genéticamente diferentes, cada uno de los cuales fabricará distintos anticuerpos, capaces de unirse a la enorme cantidad de antígenos diferentes que entran en un organismo. Esto se consigue mediante la fragmentación de parte del ADN que lleva información para la síntesis de anticuerpos y el posterior reagrupamiento de los segmentos cortos formados (reordenamiento génico). Los genes implicados se localizan, en el ser humano, en los cromosomas 2, 14 y 22.
De este modo, a partir de unos pocos genes iniciales se obtiene una gran cantidad de combinaciones génicas distintas (diversidad combinatorial), lo cual explica la enorme variedad de anticuerpos que se pueden formar. Se calcula que se pueden sintetizar unos mil millones de anticuerpos diferentes, aunque cada linfocito (y sus descendientes) produce un único tipo de anticuerpo específico.
En el sistema inmunitario solo hay unos pocos linfocitos B diferenciados que, además, se encuentran inactivos. Cuando aparece un antígeno, tiene lugar su unión a un anticuerpo de la membrana de un determinado linfocito B. La unión únicamente es posible si existe un acoplamiento espacial entre ambas moléculas; es necesaria una conformación complementaria entre la estructura del antígeno y la del anticuerpo.
El reconocimiento antigénico se fundamenta, por tanto, en la especificidad de la unión con el anticuerpo correspondiente. Dada la enorme variedad de anticuerpos, siempre hay alguno capaz de reconocer a un antígeno concreto. La unión puede ser fuerte o débil. En el primer caso, la respuesta inmunitaria generada es más intensa.
4.3.2 Teoría de la selección clonal
Tras el reconocimiento del antígeno, los linfocitos B se activan. Esta activación consiste en la rápida división de estas células para dar lugar a una serie o clon de células iguales productoras del mismo tipo de anticuerpo. Así, además de aumentar considerablemente el número de linfocitos después de la exposición al antígeno, se generan los anticuerpos específicos correspondientes.
De esta forma, la propia aparición del antígeno sería la causa de una selección clonal por la que se obtiene un gran número de linfocitos B productores de los anticuerpos necesarios contra ese antígeno. Algunos anticuerpos permanecen fijos en la membrana de los linfocitos B y otros se liberan.
Esta teoría de la selección clonal, elaborada por F. M. Burnet, permite explicar por qué se producen grandes cantidades de anticuerpos específicos tras la introducción de un determinado antígeno.
Es el propio antígeno el que, por su unión específica a un linfocito determinado de entre los millones existentes, induce a este a originar, a partir de él, un clon encargado de rechazarlo.
Los linfocitos que no contactan con el antígeno específico no se activan, pero siguen disponibles por si este aparece en el futuro.
La mayor parte de los linfocitos B activados se convierten en las llamadas células plasmáticas. Estas células del sistema inmunitario se caracterizan por su elevado tamaño y por una enorme producción de anticuerpos (aproximadamente 10 000 moléculas/célula/minuto).
Sin embargo, algunos quedan como linfocitos B de memoria, que tienen una vida ilimitada y constituyen una reserva inmunitaria para exposiciones futuras al mismo antígeno.
Tanto las células plasmáticas como las de memoria se acumulan en la zona cortical de los ganglios linfáticos del organismo, desde donde pasan a la linfa y de esta a la circulación sanguínea.
La activación de los linfocitos B se intensifica mucho por la acción de las interleucinas, sustancias generadas por los macrófagos y ciertos linfocitos T.
4.3.3 La memoria inmunológica. Respuesta inmune 1ª y 2ª
El organismo desarrolla un sistema de memoria inmunológica en el cual, como si de un archivo se tratara, almacena información acerca de estos antígenos. El proceso consiste en la formación de unos linfocitos B de memoria que permanecen en el organismo incluso después de eliminar el antígeno por completo.
Se denomina respuesta inmune primaria frente a un determinado antígeno a la que se origina cuando es la primera vez que dicho antígeno penetra en el organismo e induce la síntesis de anticuerpos por primera vez.
En esta respuesta los anticuerpos formados son del tipo IgM y se empiezan a detectar en la sangre, de modo creciente, es decir su concentración va aumentando hasta alcanzar un máximo al cabo de varios días. A partir de aquí, la concentración de inmunoglobulinas en sangre comienza a disminuir hasta que desaparece totalmente. Esto obedece a fenómenos de adaptación, proliferación y secreción de las células plasmáticas que son las encargadas de fabricar anticuerpos.
Si, pasado un tiempo, se produce un segundo contagio con el mismo antígeno, se produce una respuesta inmune secundaria. En el organismo, tras la respuesta primaria, han quedado células de memoria que rápidamente comienzan la fabricación de inmunoglobulinas en gran cantidad, se forman inmunoglobulinas de tipo IgG e IgA (más afines por el antígeno y producidas en mayor cantidad), que neutralizan al antígeno. Esta respuesta es más rápida y mucho más potente que la primaria.
La respuesta inmunitaria es tan rápida y eficaz que en muchas ocasiones el antígeno es eliminado antes incluso de que se produzca ningún síntoma apreciable. Esta es la causa de que tras padecer y superar una enfermedad infecciosa, la reinfección no sea posible en un periodo variable de tiempo. En algunos casos (sarampión, varicela o rubeola), la inmunidad adquirida dura toda la vida.
La vacunación constituye un sistema de inmunización activa producido sin desarrollar una actividad patológica, que se basa en la síntesis de linfocitos B de memoria mediante la inoculación de gérmenes no virulentos en un individuo sano para inducir la síntesis de anticuerpos.
4.4 Inmunidad celular
Además de la acción de los anticuerpos sobre los antígenos, existe otro proceso defensivo, conocido como inmunidad celular o inmunidad mediada por células, sin producción de anticuerpos.
Este proceso resulta muy eficaz en la destrucción de:
a) Células extrañas a un organismo procedentes de otro individuo distinto, aunque sea de la misma especie (por ejemplo, los órganos trasplantados).
b) Células propias tumorales.
c) Células infectadas por virus.
d) Células que contienen un microorganismo de crecimiento intracelular, como la bacteria Mycobacterium o el protista Leishmania, entre otros.
Existen dos tipos de linfocitos implicados en esta respuesta: los linfocitos T y los denominados linfocitos no-B no-T.
4.4.1 Linfocitos T
Los linfocitos T adquieren su especialidad en el contacto con las células del timo. No producen anticuerpos, por lo que se dice que son responsables de la inmunidad celular, ya que su especialidad es interaccionar con células eucariotas, extrañas o, especialmente, las del propio organismo.
Como pasaba con los linfocitos B, cuando los linfocitos T se activan (ante la presentación de antígenos o por la presencia de interleucinas) empiezan a proliferar muchísimo pues son de la estirpe necesaria para combatir al antígeno. Algunos de los linfocitos T, como pasaba con los linfocitos B, se convierten en linfocitos T de memoria para prevenir futuros incidentes con los mismos microorganismos.
Los linfocitos T poseen receptores de antígenos que varían en cada estirpe celular (como pasaba en los linfocitos B). La diferencia con estos es que no pueden identificar antígenos libres y que necesitan que les sean presentados por una célula presentadora de antígenos (normalmente un fagocito que ha digerido a la fuente de los antígenos y los presenta en su membrana junto a un autoantígeno que ya presentaba: ambos forman un complejo antigénico).
Se distinguen dos clases de autoantígenos:
a) MHC-I; se encuentran en todas las células nucleadas del organismo. Los reconocen los linfocitos T8.
b) MHC-2; solo se localizan en las células presentadoras de antígenos y en los linfocitos B. Los reconocen los linfocitos T4.
Destacamos tres clases principales de linfocitos T:
a) Linfocitos T colaboradores o cooperadores (T4-glucoproteína CD-4). Estos linfocitos se encargan de regular la respuesta inmune provocando un aumento del número y la actividad de los macrófagos (T2) o estimulando a otros linfocitos T y a los linfocitos B (T1) produciendo distintos tipos de interleucina.
b) Linfocitos T citotóxicos (T8-glucoproteína CD-8). Actúan de forma específica destruyendo células diana que portan antígenos extraños en su superficie. Van a eliminar estas células produciendo perforinas (proteínas que hacen agujeros en la membrana celular de la célula diana haciendo que se lise) o activando endonucleasas en esas células (apoptosis-"suicidio" celular).
c) Linfocitos T supresores (T8). Disminuyen la respuesta del sistema inmune de dos formas:
· Desactivan los linfocitos activados por medio de la formación de unos factores supresores. Esto sucede cuando se ha conseguido controlar a los agentes antigénicos o cuando la respuesta inmunitaria es excesiva y podría resultar peligrosa para el propio organismo.
· Producen una tolerancia inmunológica a los autoantígenos para evitar el ataque a las propias células del organismo.
Como se verá más adelante, un funcionamiento anómalo de los linfocitos T, puede originar alergias y enfermedades autoinmunes.
4.4.2 Linfocitos no-B no T
Estas células son minoritarias (representan menos del 3% del total de linfocitos), pero desempeñan un papel importante en ciertos casos. Estos linfocitos presentan algunas características diferentes a las del resto: poseen gránulos citoplasmáticos y tienen una actuación inespecífica, pues no reconocen antígenos específicos (por eso ya hablamos de ellas en el punto anterior).
Por otra parte, tras la estimulación, su número no aumenta ni originan memoria inmunológica. Sin embargo, se incluyen en este grupo de leucocitos, ya que pertenecen a la serie linfoide. Existen dos tipos de linfocitos no-B no-T:
a) Células K o células asesinas. Atacan a las células recubiertas por anticuerpos y segregan perforinas, como los linfocitos T citotóxicos, para destruirlas. A pesar de producir una muerte celular dependiente de la existencia de anticuerpos sobre la célula diana, las células K tienen una actuación inespecífica, ya que no diferencian los distintos tipos de anticuerpos.
b) Células NK o células asesinas naturales. Actúan de manera semejante a las anteriores, destruyendo, en este caso, células afectadas por virus y cancerosas, así como las pertenecientes a órganos trasplantados.
Como ya hemos visto, el interferón producido por las células atacadas por virus favorece la actuación de las células NK. Su estímulo es la ausencia de las proteínas correctas del MHC de la clase I.
Actualmente se cree que las células NK siempre están activas, pero se desactivan al unirse a las células normales del individuo (es decir, a las que tienen las proteínas normales del MHC de la clase I).
Las células NK también producen linfocinas que regulan a los linfocitos B y T.
5. Tolerancia inmune
Una cuestión primordial en la comprensión de los mecanismos inmunitarios es encontrar una respuesta satisfactoria al hecho de que las células del sistema inmunitario sean capaces de reconocer los antígenos extraños y eliminarlos, pero sin rechazar a los antígenos propios (autoantígenos).
Desarrollar la capacidad para diferenciar lo propio de lo extraño constituye uno de los objetivos de toda acción inmunitaria. Esto se consigue aunque a veces los antígenos extraños y los propios están compuestos por moléculas muy semejantes.
La capacidad del sistema inmunitario para reconocer los antígenos propios y no rechazarios se denomina tolerancia inmune y es imprescindible para impedir la autodestrucción del organismo.
La teoría de la selección clonal, aunque no ha sido totalmente demostrada, proporciona una explicación del mecanismo por el que se lleva a cabo este proceso. Como se sabe, las células T inmaduras procedentes de la médula ósea se diferencian en el timo. Durante su maduración, interaccionan, por medio de los receptores de su membrana, con los autoantígenos del MHC presentes en las células propias que contactan con ellas. Las células T que no tienen receptores adecuados para esa unión son eliminadas.
Así, se produce una selección positiva, ya que únicamente sobreviven aquellas células capaces de interaccionar con las moléculas propias.
A continuación, tiene lugar una fase de selección negativa, en la que son eliminadas las células autorreactivas que pueden unirse a autoantígenos del MHC acoplados con otros antígenos propios, provocando una respuesta inmunitaria. Únicamente permanecerán los linfocitos T que no producen respuesta autoinmunitaria, aunque sus receptores se unan a los autoantígenos. Se consigue así que exista una tolerancia inmune por la que no se produce una acción contra las células del organismo.
Un mecanismo similar al descrito permite que se seleccionen los linfocitos B que no producen anticuerpos contra los autoantígenos. En este caso, el proceso de maduración y selección se lleva a cabo en la médula ósea (en los mamíferos).
Dependiendo de los mecanismos implicados en la resistencia frente a los microorganismos patógenos, se puede hablar de dos tipos de inmunidad:
a) Inmunidad innata. Relacionada con los mecanismos inespecíficos de las dos primeras líneas de defensa, que son independientes del contacto previo con los patógenos.
b) Inmunidad adquirida. Supone la aparición de memoria protectora específica tras el contacto con los patógenos. Es más protectora que la inmunidad innata y puede lograrse de forma activa o pasiva.
6.1. Inmunización adquirida
La inmunidad adquirida puede deberse a procesos naturales o bien a la aplicación de ciertas técnicas médicas. En el primer caso se habla de inmunidad natural, y en el segundo, de inmunidad artificial.
En cada uno de estos tipos, la inmunidad puede ser pasiva, si se adquiere al recibir anticuerpos específicos fabricados por otro organismo, o activa, si el propio organismo sintetiza los anticuerpos tras la introducción del antígeno, gracias a sus defensas inmunitarias.
A) Inmunidad natural pasiva. Se adquiere por la transferencia de anticuerpos de la madre al feto y al niño lactante, a través de la placenta y de la leche materna, respectivamente. De esta forma, el niño recibe anticuerpos de manera constante en un período durante el cual su sistema inmunológico aún no está desarrollado por completo.
B) Inmunidad natural activa. Se produce después de superar una enfermedad infecciosa, ya que el organismo queda cargado con los anticuerpos sintetizados y, sobre todo, con linfocitos de memoria, por lo que durante un tiempo (en ocasiones toda la vida) se evita la reinfección.
C) Inmunidad artificial pasiva y activa. También denominada proceso de inmunización, se obtiene estimulando el sistema inmunitario del individuo por medio de técnicas médicas como la vacunación.
6.1. Inmunización pasiva
La inmunización pasiva consiste en la introducción en el organismo de anticuerpos sintetizados previamente por otra persona o por un animal. Es un proceso curativo y no preventivo: se usa cuando el paciente ya sufre la infección. Este procedimiento tiene unas ventajas evidentes:
a) Proporciona una protección inmediata, lo que puede ser importante en los casos en que se necesiten anticuerpos rápidamente.
b) Al no ser necesaria la síntesis propia de anticuerpos, esta inmunidad resulta útil en individuos con deficiencias en su sistema inmunitario.
Sin embargo, también presenta una serie de inconvenientes:
a) Se obtiene una inmunidad de duración limitada, ya que los anticuerpos administrados desaparecen del cuerpo del receptor pasado un tiempo.
b) Existe el riesgo de transmitir las enfermedades padecidas por el individuo del que se han obtenido los anticuerpos.
c) Si los anticuerpos proceden de la sangre de un animal pueden producirse reacciones de rechazo contra alguna proteína de este.
Para llevar a cabo la inmunización pasiva es preciso obtener previamente los anticuerpos. Para ello se inocula el antígeno correspondiente a un animal, que sintetiza así los anticuerpos contra una enfermedad determinada.
También se pueden obtener de la sangre de individuos hiperinmunes que posean gran cantidad de los anticuerpos que se precisan.
Para evitar los inconvenientes de obtener los anticuerpos de otros animales actualmente se emplean anticuerpos monoclonales obtenidos mediante ingeniería genética (biotecnología).
En la inmunización pasiva se emplean dos tipos de sustancias:
A) Sueros o antisueros. Contienen solo anticuerpos específicos.
B) Gammaglobulinas. Son mezclas de anticuerpos obtenidos de la sangre de un organismo inmune, entre los que se encuentran los que interesan.
La inmunización pasiva tiene una gran utilidad en la lucha contra la rabia, el tétanos y la difteria, en personas no vacunadas, ya que son enfermedades muy graves que se desarrollan con rapidez. Resulta adecuada, asimismo, en enfermedades para las que no existen vacunas eficaces, como la hepatitis A.
6.2. Inmunización activa. La vacunación
Como ya sabes, la inmunización activa se basa en la estimulación artificial del propio sistema inmunológico de un individuo mediante el suministro de los antígenos necesarios para que el organismo pueda sintetizar por sí mismo los anticuerpos contra ellos.
La vacunación es una forma de inmunización activa, ya que estimula las defensas inmunitarias frente a determinados agentes patógenos o sustancias dañinas, sin desarrollar la enfermedad.
Así, si el individuo queda expuesto de nuevo a estos agentes patógenos, sus células de memoria sintetizarán rápidamente anticuerpos para combatirlos. Se trata, por tanto, de un método profiláctico (preventivo), que prepara el organismo ante un posible contacto con el agente patógeno correspondiente.
Como ya vimos antes, la persona vacunada fabrica linfocitos de memoria que permiten producir una respuesta inmunitaria secundaria más rápida y mucho más intensa (entre 10 a 100 veces mayor) que la respuesta primaria cuando se expone a un microorganismo patógeno.
Gracias a la vacunación se han obtenido unos resultados espectaculares en la lucha contra las enfermedades infecciosas, algunas de las cuales, como la viruela, han sido erradicadas. Sin embargo, no siempre es posible obtener las vacunas adecuadas; en la actualidad se están realizando numerosas investigaciones para desarrollar vacunas efectivas contra el VIH o el virus de la hepatitis C.
Para que una vacuna pueda ser suministrada debe cumplir dos requisitos básicos:
a) Capacidad inmunógena. La vacuna debe ser capaz de provocar una respuesta inmunitaria eficaz. Aunque ninguna vacuna posee una efectividad inmunógena del 100% (es decir, todos los individuos vacunados quedan inmunizados), el nivel de protección que proporcione debe ser siempre suficiente.
b) Ser seguras y no producir efectos secundarios serios. Si la inoculación de la vacuna provoca el desarrollo de la enfermedad o bien la aparición de otros problemas importantes, no puede ser utilizada.
6.2.1 Breve historia de las vacunas
La búsqueda de un sistema para evitar el contagio de enfermedades infecciosas ha sido siempre una aspiración del ser humano. Desde tiempos muy remotos se había observado que las personas que sobrevivían a enfermedades infecciosas no volvían a contraerlas. Por esta razón se les dedicaba al cuidado de los enfermos durante las epidemias.
Los primeros intentos médicos de provocar una inmunización sin padecer previamente la infección se llevaron a cabo en China en épocas muy lejanas. Se elaboraba un preparado desecado a partir de costras de enfermos de viruela, que se hacía inhalar a una persona sana o se aplicaba sobre una erosión producida en la piel, consiguiendo de esta manera en muchos casos que el individuo se inmunizara. Sin embargo, era frecuente que se produjera el contagio de la enfermedad por la propia inoculación del preparado e incluso la muerte del paciente. Este método, llamado variolización, fue introducido en Europa a finales del siglo XVI.
En la misma época, el médico rural inglés Edward Jenner observó que los ganaderos padecían una enfermedad benigna, la viruela vacuna, que los hacía inmunes a la viruela negra humana (una de las enfermedades más letales de la historia). Aplicando un extracto de las pústulas de una persona afectada por la enfermedad de las vacas, al que denominó vaccinia o vacuna, consiguió una protección eficaz sin los riesgos de la variolización. Esto resultó posible porque los microorganismos que producen la viruela vacuna y la viruela humana tienen antígenos comunes y se produce una inmunidad cruzada. Desgraciadamente en muchas otras enfermedades este método era inútil porque no disponían de microorganismos atenuados de la enfermedad.
En 1880, Louis Pasteur descubrió que algunos factores modificaban la capacidad infectiva de aquellos microbios causantes de las enfermedades infecciosas.
Observó que un cultivo de laboratorio de la bacteria que produce el cólera de las gallinas perdía su virulencia después de unos meses, pero al inocularlo en animales sanos estos desarrollaban inmunidad frente al agente patógeno.
Comprobó este mismo fenómeno en el ántrax del ganado cuando calentó un cultivo de la bacteria causante de esta enfermedad.
En 1885 logró inmunizar a un niño, que había sido mordido por un perro y que aún no había desarrollado la rabia, con un extracto seco de la médula espinal extraída de animales rabiosos.
En honor a la vacuna de Jenner, Pasteur bautizó este método que permitía la inmunización inoculando microorganismos no virulentos con el nombre de vacunación.
Por la misma época, Emil von Böhring y Shibasaburo Kitasato descubrieron la inmunización pasiva al suministrar suero de animales inmunes para el tétanos. A las sustancias antitóxicas presentes en el suero se les llamó anticuerpos. Después se elaboraron sueros contra la toxina diftérica.
También a finales del siglo XIX, Paul Ehrlich descubrió la diferencia entre la respuesta inmune secundaria y primaria, y llevó a cabo otros estudios que sentaron las bases de los aspectos cuantitativos de la inmunización.
6.2.2 Tipos de vacunas
Según el origen y la naturaleza de los antígenos se distinguen varios tipos de vacunas: atenuadas, inactivadas y acelulares.
A) Atenuadas. Contienen microorganismos vivos, aunque debilitados, que se reproducen en el individuo inoculado y originan una infección muy limitada.
En respuesta, el organismo del hospedador fabrica gran número de anticuerpos y linfocitos B de memoria que proporcionan una inmunidad intensa y de larga duración.
Los microorganismos atenuados son cepas mutantes no virulentas que se obtienen a partir de cepas normales que se cultivan en condiciones subóptimas (por ejemplo, con temperaturas cercanas a su máximo tolerable) hasta que pierden los elementos implicados en la patogenicidad (por ejemplo, los plásmidos que portan información para la síntesis de toxinas). En este proceso los antígenos no se alteran. Las vacunas contra la poliomielitis, el sarampión y la rubeola son atenuadas.
B) Inactivadas. En este caso, los microorganismos están muertos, por lo que no pueden reproducirse en el organismo y es preciso suministrar una dosis mayor para que la vacuna contenga los antígenos suficientes. Con frecuencia son necesarias dosis de recuerdo para estimular a los linfocitos B de memoria.
La inactivación de un microorganismo se consigue por medio de productos químicos, como el formol, o por la aplicación de calor intenso. Este último procedimiento modifica la superficie celular y puede alterar los antígenos, así que no se emplea habitualmente en la preparación de las vacunas inactivadas.
Las vacunas contra la rabia, la fiebre tifoidea, la tosferina y la difteria son de este tipo.
C) Acelulares. No están compuestas por células completas; contienen solo partes o productos de los microorganismos. Pueden ser toxoides, antígenos aislados o anticuerpos antiidiotípicos producidos por otro organismo.
· Toxoides. Son toxinas alteradas por efecto del calor o de agentes químicos, aunque conservan su capacidad inmunógena, por lo que estimulan la síntesis de los anticuerpos (antitoxinas) correspondientes.
Se emplean en la inmunización contra microorganismos productores de exotoxinas potentes (tétanos y difteria).
· Antígenos aislados. Estos no contienen otros componentes innecesarios, por lo que no provocan reacciones adversas. Entre ellos se encuentran algunos polisacáridos con capacidad inmunógena que se utilizan en la preparación de la vacuna contra el neumococo.
Gracias a las técnicas de ingeniería genética, se dispone en la actualidad de vacunas de este tipo para la hepatitis B y para la meningitis meningocócica.
Asimismo, se han sintetizado péptidos cortos que actúan como determinantes antigénicos, tras su unión a una molécula transportadora adecuada. En este caso es necesario conocer previamente y con exactitud la estructura química del antígeno. Se ha conseguido una vacuna de este tipo para combatir la glosopeda, una enfermedad vírica del ganado.
La vacuna contra la malaria desarrollada por el inmunólogo colombiano Manuel Patarroyo constituye un caso especial, ya que se ha obtenido uniendo tres fragmentos antigénicos diferentes del protozoo Plasmodium, causante de la enfermedad, es decir, se ha creado una molécula sintética nueva con capacidad inmunógena para distintos antígenos.
La vacuna del papiloma humano se ha obtenido tras la producción por ingeniería genética de la proteína mayoritaria de la cápsida del virus del papiloma humano y su posterior autoensamblaje. Las cápsidas tienen capacidad antigénica y, al no contener material genético, son inocuas.
· Antiidiotípicas. Estas vacunas utilizan como moléculas antigénicas anticuerpos producidos contra anticuerpos. El método consiste en obtener anticuerpos contra el antígeno para el que se desea la inmunización.
Los anticuerpos sintetizados por un organismo (Ab1), a su vez, son inmunógenos para otro organismo y tras su inoculación se forman anticuerpos (Ab2 o antiidiotípicos) contra ellos.
Los anticuerpos antiidiotípicos se pueden emplear como vacunas, ya que poseen zonas altamente específicas con la misma estructura química que el antígeno original, y pueden inducir inmunidad. Estas vacunas están libres de antígenos y son inocuas. Se han usado con éxito vacunas antiidiotípicas contra la rabia y otras enfermedades en animales de laboratorio. Se prevé su utilización futura en el ser humano contra tumores y herpes.
7. Alteraciones del sistema inmunitario
A veces se producen alteraciones y errores que se traducen en una serie de anomalías en el funcionamiento del sistema inmunitario. Esto puede llegar a provocar graves enfermedades en el organismo.
Se diferencian dos tipos de alteraciones del sistema inmunitario, debidas unas a una acción inmunitaria insuficiente y otras desencadenadas por una respuesta excesiva o innecesaria.
7.1. Inmunodeficiencia
Una inmunodeficiencia es la incapacidad para desarrollar una respuesta inmunitaria adecuada ante la presencia de antígenos extraños, es decir, estos no son eliminados correctamente.
Como consecuencia de ello, las estructuras antigénicas no rechazadas pueden causar graves lesiones en el hospedador.
Esto es particularmente importante en el caso de los microorganismos invasores, ya que las personas que presentan estas alteraciones padecerán infecciones recurrentes más o menos graves según el grado de su deficiencia inmunitaria. Existen dos clases de inmunodeficiencias: las congénitas y las adquiridas.
7.1.1 Inmunodeficiencia congénita
Aunque las inmunodeficiencias congénitas no son frecuentes, suelen ser muy graves. Se desarrollan en los primeros años de vida.
El estudio de este tipo de enfermedades ha permitido esclarecer algunos mecanismos de la función inmunitaria. Las inmunodeficiencias congénitas pueden provocar anomalías en las defensas inespecíficas o en las específicas.
Anomalías en las defensas inespecíficas son, por ejemplo:
a) Enfermedad granulomatosa crónica. Se trata de una enfermedad hereditaria ligada al cromosoma X. Los neutrófilos no pueden realizar la fagocitosis, por lo que se producen frecuentes infecciones bacterianas.
b) Deficiencia en el componente C5 del complemento. El funcionamiento anormal de esta proteína impide las acciones derivadas de su activación.
Las anomalías en las defensas específicas son más graves. Entre ellas destacan:
a) Agammaglobulinemia. Se trata de una enfermedad ligada al cromosoma X. Una grave deficiencia de los linfocitos B impide la producción de anticuerpos. En algunos casos solo existe una deficiencia en la producción de IgA, en otros casos, del resto de inmunoglobulinas.
b) Síndrome de Di George. El individuo afectado carece de timo, por lo que la deficiencia afecta a la función de los linfocitos T.
c) Inmunodeficiencia combinada grave. En este caso, la deficiencia de linfocitos B y T provoca infecciones graves y continuas que causan la muerte a menos que se realice un trasplante de médula ósea para obtener células precursoras de los leucocitos. Los niños con esta enfermedad deben permanecer en ambientes estériles (niños burbuja) hasta recibir el trasplante y poder generar los linfocitos.
7.1.2 Inmunodeficiencia adquirida. El SIDA
En este tipo de enfermedades, más frecuentes que las inmunodeficiencias congénitas, la deficiencia inmunitaria no tiene origen genético y aparece en cualquier momento de la vida como consecuencia de diversos factores, entre los que figuran la leucemia, la exposición a radiaciones o el tratamiento durante largo tiempo con inmunosupresores como los esteroides. Asimismo, algunas enfermedades graves que debilitan el sistema inmunitario pueden provocar su aparición.
EL SIDA
Entre las inmunodeficiencias adquiridas más graves, ya que no se dispone de un tratamiento efectivo para combatirlas, se encuentra el sida (síndrome de inmunodeficiencia adquirida), producido por el VIH (virus de la inmunodeficiencia humana, que ataca y destruye los linfocitos T4. La inmunodeficiencia provocada impide una defensa eficaz contra los antígenos microbianos y contra las células tumorales, por lo que la persona afectada sufre infecciones importantes y desarrolla algunos tipos de cánceres.
El VIH fue identificado y aislado por primera vez por L. Montaigner el año 1983, en el Instituto Pasteur de París, y, posteriormente, por R. Gallo, del Instituto Nacional del Cáncer en Estados Unidos.
Posteriormente se descubrió un segundo virus muy similar, por lo que actualmente se admiten dos subtipos del VIH, denominados VIH-1 y VIH-2. Parece ser que el VIH-2 está relegado a determinadas zonas de África y que aparentemente es menos agresivo. El VIH-1 es el que ha adquirido una propagación universal y al que nos referiremos en este tema.
El VIH es un retrovirus de tamaño variable (80-100 nm) y consta de:
a) Envoltura externa. Formada por una bicapa lipídica, procedente de la célula infectada, con glicoproteínas virales. Una de ellas, la denominada Gp 120, que sobresale al exterior, es la que permite al virus adherirse a aquellas células humanas en cuya superficie esté el receptor CD-4 (linfocitos T colaboradores).
b) Cápsida. De simetría icosaédrica, con una doble envoltura de proteínas.
c) Material genético. Formado por DOS cadenas de ARN bicatenario, de unos 10000 pares de bases, al que acompañan tres enzimas, una transcriptasa inversa que permite transcribir el ARN en ADN, otra integrasa o endonucleasa, que permite al ADN de doble cadena viral insertarse en el ADN del linfocito, y una proteasa, que permite el correcto montaje de la estructura del virus.
Es importante ser consciente de la alta capacidad y facilidad de mutación del virus, de ahí, en parte, la alta dificultad de encontrar una vacuna realmente eficaz.
DESARROLLO DEL SIDA
Hemos destacado su afinidad por las células portadoras del receptor CD-4. Estas células son, además de los linfocitos T-4 y los macrófagos y monocitos, muchas células nerviosas y de la mucosa digestiva. El virus se une a dichas células y pasa a su interior reproduciéndose según los ciclos lítico y lisogénico que hemos estudiado en el tema anterior.
El proceso infeccioso de la enfermedad se puede resumir en CUATRO etapas:
a) Contagio del virus; el VIH penetra en el cuerpo de una persona sana procedente de otra persona infectada. El virus se localiza en la sangre y en otros fluidos orgánicos como el semen y las secreciones vaginales (ETS), desde donde accede al nuevo hospedador. Los principales mecanismos de transmisión son:
· Directamente a través de la sangre, por transfusiones o por medio de jeringuillas contaminadas.
· Mediante relaciones sexuales en las que el semen o bien las secreciones vaginales entren en contacto con microheridas y erosiones por las que el virus pueda introducirse. Debe prevenirse con el uso del preservativo. En los últimos años se ha perdido parte del miedo al SIDA al disponerse de medicamentos que alargan mucho la vida de los enfermos y permiten evitar muchas de las enfermedades asociadas pero debemos seguir evitando los contagios o nos arriesgamos a que la situación vuelva a empeorar mucho.
· De madre a hijo, generalmente durante la gestación, el parto o la lactancia. Para evitarlo es importante que la madre sepa que tiene la enfermedad porque con la medicación adecuada se pueden mantener una carga viral lo suficientemente baja como para evitar la transmisión al feto o al bebé.
La transmisión del VIH no se produce a través de los alimentos, ni por la picadura de insectos ni durante las relaciones habituales de convivencia en los centros escolares, en el trabajo o en el seno familiar.
b) Etapa de infección; dura entre 1 y 6 semanas desde el momento del contagio. Presenta síntomas parecidos a una gripe, es decir, fiebre, cefaleas, inflamación de los ganglios linfáticos, dolores musculares, etc. En este período aún no se detectan anticuerpos en el plasma, pero el virus está presente y el enfermo puede transmitirlo.
Gracias a la transcriptasa inversa (una ADN polimerasa) se forma ADN bicatenario a partir del ARN, que se incorpora al genoma del linfocito, y se constituye un provirus, de modo que el ADN de este, integrado en el ADN celular, se transmite a las células hijas cada vez que el linfocito se divide. En esta etapa no se observan alteraciones en las células con el ADN vírico, pero todas tienen una copia de este en su propio genoma. Se produce, además, una multiplicación lenta del virus, que se libera por gemación. Los linfocitos no sufren daños inmediatos, pero sí a largo plazo.
b) Fase asintomática. Puede durar desde meses a años. En este período ya se detectan los anticuerpos contra el virus, individuos seropositivos, y parece que hay un cierto equilibrio entre el virus y el sistema inmunitario, pudiéndose presentar fases agudas similares a la del período de infección, que corresponden a momentos de actividad replicadora del virus. En esta fase, el enfermo también puede transmitirlo.
c) Deterioro del sistema inmunitario y SIDA. En cierto momento, los linfocitos T4 infectados mueren. El descenso en su número es lo que provoca la inmunodeficiencia. Cuando existen menos de 150 linfocitos T4 por mm3 de sangre (en una persona sana hay 500/mm3), la deficiencia inmunitaria es grave y la capacidad defensiva del sistema inmunitario se va debilitando, no sólo contra el virus sino también contra cualquier otra enfermedad. Se aprecian lesiones en el sistema nervioso y en el digestivo.
Al desaparecer las defensas proliferan las infecciones oportunistas causadas por hongos o protozoos que normalmente son fácilmente derrotadas, y determinados tipos de cáncer. Son muy características las neumonías, causadas por el protozoo Pneumocystis carinii, y los trastornos digestivos producidos por el hongo del género Candida. Entre los tipos de cáncer son típicos el sarcoma de Kaposi (tumoraciones rojo-violaceas en la piel) y los linfomas (tumores de los ganglios linfáticos). El final es bien conocido, la muerte.
Un problema muy serio de esta enfermedad es que el tiempo que suele transcurrir desde el momento de la infección por el VIH hasta la aparición del sida oscila entre 5 y 10 años. Durante este periodo, la persona infectada puede transmitir el virus sin ser consciente de ello.
LUCHA CONTRA EL SIDA
Aún no se dispone de un tratamiento eficaz para combatir esta grave enfermedad. La combinación de medicamentos que se emplea en la actualidad retarda la progresión del síndrome, pero no consigue eliminar el virus ni, por tanto, lograr la curación.
El tratamiento se basa en una terapia antirretroviral con una combinación de fármacos:
a) Inhibidores de la transcriptasa inversa análogos a los nucleótidos. Se unen como un nucleótido más a la cadena de ADN que se está formando a partir del ARN viral, interrumpiendo su síntesis. Entre ellos se encuentra el AZT, el DDL, el 3TC y el d4T.
b) Inhibidores de la transcriptasa inversa no análogos a los nucleótidos. Inhiben la actividad de esa enzima por un mecanismo diferente, entre ellos se encuentra la neviparina y el efavirenz.
c) Inhibidores de las proteasas. Impiden que las proteasas rompan las proteínas sintetizadas a partir del material genético del virus, así no se pueden ensamblar y conformar las diferentes cubiertas del virión. Los más conocidos son ritonovir y indanivir.
d) Inhibidores de fusión. Previenen la entrada del VIH a las células al impedir la unión del virus a los receptores CD-4.
Gracias a la combinación de medicamentos se ha logrado aumentar la esperanza de vida de las personas afectadas, de forma que se está cerca de considerar el sida como una enfermedad crónica, pero no mortal. Las principales causas de mortalidad en infectados de VIH son debidas a las infecciones oportunistas que padecen o a la falta de constancia en el tratamiento.
Por otra parte, el método preventivo más adecuado que puede impedir el contagio en personas sanas sería la vacunación, pero hasta el momento no ha sido posible encontrar una vacuna eficaz. Actualmente, la única forma de controlar la propagación de la enfermedad consiste en el uso de la profilaxis.
Las principales medidas profilácticas que tenemos son: uso del preservativo en las relaciones sexuales, no compartir jeringuillas u objetos punzantes, extremar el control en donaciones de sangre, tejidos y órganos.
Otra medida profiláctica muy importante, además de ser fundamental para nuestra salud, es saber si tenemos la enfermedad. Si estamos contagiados debemos seguir el tratamiento de forma MUY rigurosa para mantener la carga de virus en niveles MUY bajos. Así nos cuidamos y hacemos que sea casi imposible contagiar a otros.
Como en todas las enfermedades infecciosas y en los demás temas de salud pública la mejor manera de protegernos es proteger a todos los que nos rodean. Por eso debemos ser cuidadosos y evitar los contagios.
También debemos evitar discriminar a las personas enfermas y hacer que su vida sea más difícil. Con el tratamiento y los cuidados necesarios pueden hacer una vida normal.
7.2. Hipersensibilidad. Las alergias
La hipersensibilidad se produce cuando el sistema inmunológico desencadena una respuesta inmunitaria excesiva que provoca lesiones en los tejidos del propio organismo. En la hipersensibilidad, los procesos inmunitarios no ocasionan un beneficio al organismo, sino un efecto perjudicial. La acción lesiva puede ser causada tanto por anticuerpos como por linfocitos T.
Según el efecto producido, el proceso inmunitario causante y el tiempo que tarda en aparecer tras el contacto con el antígeno, se distinguen cuatro tipos de hipersensibilidad:
a) Hipersensibilidad de tipo I (inmediata o anafiláctica).
b) Hipersensibilidad de tipo II (citotóxica).
c) Hipersensibilidad de tipo III (mediada por complejos inmunitarios).
d) Hipersensibilidad de tipo IV (retardada).
7.2.1 Hipersensibilidad de tipo I (inmediata o anafiláctica)
Conocida también como reacción alérgica o alergia. El desarrollo de esta hipersensibilidad es muy rápido, pues se produce entre los 10 y 20 minutos tras la exposición al antígeno, que en este caso se denomina alérgeno.
Entre los alérgenos más comunes se encuentran: el veneno de abejas, proteínas de las células del polen, esporas de mohos, heces de ácaros del polvo, caspa del pelo de animales, medicamentos (como la penicilina), alimentos (mariscos, cacahuetes), ...
DESARROLLO DE LA REACCIÓN ALÉRGICA
La reacción alérgica se desarrolla en dos pasos:
A) Sensibilización. La primera exposición al alérgeno provoca un estímulo de los linfocitos TH que, a su vez, inducen la activación de los linfocitos B. Estos fabrican inmunoglobulinas IgE, que se unen por su zona constante a los leucocitos basófilos y a los mastocitos (células fijas localizadas cerca de los capilares sanguíneos), fijándose a la superficie externa de su membrana.
Se dice entonces que se ha producido la sensibilización, la cual depende de la producción de IgE. La causa última de la sensibilización al alérgeno no se conoce. Parece ser, aunque aún no se ha demostrado, que la formación de las IgE depende, al menos en parte, de la información genética del individuo. También se ha atribuido a una deficiencia de los linfocitos. TS encargados de evitar una actuación excesiva del sistema inmunitario.
B) Nueva exposición al alérgeno. Una vez producida la sensibilización, y tras una nueva exposición al alérgeno, este se une a las IgE fijadas previamente a los mastocitos y basófilos, lo cual provoca su desgranulación que, como ya hemos estudiado, consiste en la secreción de sustancias que se encuentran en el citoplasma celular. Para que se produzca la des- granulación es preciso que el alérgeno se una, al menos, a dos moléculas de IgE.
Las sustancias expulsadas son mediadores de la inflamación (histamina, prostaglandinas y leucotrienos). Los síntomas y manifestaciones del proceso alérgico se derivan de la acción de estas sustancias, que pueden desencadenar reacciones locales (inflamación cutánea con enrojecimiento, hinchazón y picor o aumento de la secreción nasal y lacrimal) o reacciones generalizadas (contracción de los músculos de bronquios y bronquiolos, que genera dificultades respiratorias, asma o bien una importante vasodilatación general). En este último caso se puede producir la muerte por asfixia o bien por un descenso acusado de la presión sanguínea (shock anafiláctico).
El tratamiento de los procesos alérgicos se basa en la administración de antihistamínicos, para neutralizar la acción de la histamina, y también de otros medicamentos, para aumentar la presión sanguínea y dilatar los bronquios.
La solución ideal, sin embargo, consiste en desensibilizar al individuo mediante técnicas de inmunoterapia. Para ello se realizan pruebas cutáneas con el fin de identificar el alérgeno responsable. Una vez detectado, este se administra en dosis crecientes hasta conseguir la desensibilización. Con este método se forman unos anticuerpos bloqueantes (IgG) que al unirse al alérgeno impiden que este se una a las IgE. También puede estar implicada la producción de linfocitos Ts, que provocan una disminución de la síntesis de IgE.
7.2.2 Hipersensibilidad de tipo II (citotóxica).
En estas reacciones, los anticuerpos IgM o IgG se unen a unos antígenos que pertenecen a células humanas, lo cual activa el complemento por la vía clásica y la lisis por la vía terminal. La activación también favorece la fagocitosis.
Se encuadran en este tipo de hipersensibilidad algunas enfermedades autoinmunitarias, que se estudiarán en el siguiente punto. En ellas se produce un fallo de la tolerancia inmunitaria, creándose anticuerpos contra antígenos propios. Suelen incluirse también en este grupo el rechazo a los órganos trasplantados y la incompatibilidad entre diferentes grupos sanguíneos.
7.2.3 Hipersensibilidad de tipo III (mediada por complejos inmunitarios)
Aunque presenta muchas semejanzas con la de tipo II, los antígenos a los que se unen los anticuerpos no forman parte de células, sino que circulan libres en la sangre.
La reacción de hipersensibilidad se desencadena porque los complejos antígeno-anticuerpo creados no son eliminados por los macrófagos, como sucede normalmente. Se produce entonces una activación excesiva del complemento y una respuesta inflamatoria en la que se liberan enzimas que ejercen una acción destructiva sobre los tejidos. Los órganos afectados pueden sufrir daños importantes.
Ciertas infecciones crónicas causan esta hipersensibilidad. Asimismo, se producen reacciones de este tipo en la inmunización pasiva realizada con un suero procedente de un animal, debido a las proteínas que contiene (enfermedad del suero). Algunas enfermedades autoinmunitarias pertenecen a esta clase de hipersensibilidad.
7.2.4 Hipersensibilidad de tipo IV (retardada)
Se denomina así porque su desarrollo se produce más tarde que en los otros tipos (incluso varias semanas después de la exposición al antígeno).
A diferencia del resto de hipersensibilidades, en las de tipo IV no intervienen anticuerpos, sino un clon de células iguales. Tras una segunda exposición al mismo antígeno, los linfocitos TH de este clon celular liberan linfocinas que provocan la estimulación de los macrófagos y desencadenan un proceso inflamatorio.
Este tipo de hipersensibilidad es el causante de las dermatitis de contacto originadas por algunos cosméticos, prendas de vestir, bisutería o plantas en contacto con la piel, cuyas proteínas se unen con haptenos presentes en dichos productos y originan los antígenos desencadenantes de la reacción.
Dado que los síntomas (picor, erupción) son bastante similares a los de la hipersensibilidad de tipo I, en ocasiones estas reacciones se llaman alergias de contacto, aunque el término alergia solo se debería aplicar a la primera.
La reacción granulomatosa es un proceso muy grave de hipersensibilidad retardada. Produce daños en los tejidos internos como consecuencia de la formación de nódulos en los que existe una inflamación continua con presencia de macrófagos y monocitos. Las lesiones tisulares que caracterizan a la tuberculosis y la lepra se deben a reacciones granulomatosas.
Algunos de los procesos de rechazo de órganos trasplantados se consideran también reacciones de hipersensibilidad de tipo IV.
PRUEBA DE LA TUBERCULINA
El método diagnóstico conocido como prueba de la tuberculina que se emplea para detectar si una persona padece un proceso de tuberculosis o está inmunizada contra esa enfermedad, se basa en la hipersensibilidad de tipo IV.
Se inyecta en la piel una pequeña cantidad de antígeno de Mycobacterium tuberculosis, la bacteria causante de la enfermedad. Si el individuo ha tenido contacto con este microorganismo, a los 2 o 3 días se producirá una reacción de hipersensibilidad que se manifiesta como un endurecimiento de la piel en la zona de inoculación. Si la reacción no se produce, no ha habido exposición previa a Mycobacterium y, por tanto, el sujeto no está inmunizado contra la tuberculosis ni padece la infección.
7.3. Enfermedades autoinmunes
El sistema inmunitario normalmente es capaz de diferenciar las moléculas extrañas de las que son propias del organismo: rechaza las primeras pero no actúa contra las segundas.
La tolerancia inmunológica hacia los autoantígenos aparece durante el proceso de maduración de los linfocitos, en el que aquellos linfocitos que originan una reacción destructiva sobre las células del individuo son eliminados.
De esta forma, los únicos linfocitos que permanecen en el organismo son los que provocan acciones lesivas sobre los antígenos extraños, pero no sobre los propios (teoría de la selección clonal).
Sin embargo, en determinados casos se produce una actuación de clones de unos linfocitos que son autorreactivos y que no han sido eliminados. Como consecuencia, el sistema inmunitario ataca a las células propias en un proceso autodestructivo que da lugar a enfermedades autoinmunitarias, cuyo desarrollo es lento pero progresivo.
Algunas enfermedades autoinmunitarias están causadas por una hipersensibilidad de tipo II o de tipo III, como ya hemos visto.
No se conoce la causa última de este fallo inmunitario, aunque se cree que la activación de linfocitos autorreactivos tiene lugar por los siguientes motivos:
a) Cambios en los autoantígenos, que impiden que el sistema inmunitario los reconozca como propios.
b) Aparición de antígenos extraños cuya semejanza con los autoantígenos puede desencadenar también reacciones contra estos.
c) Aparición de células que no suelen contactar con los linfocitos, por lo que previamente no han sido reconocidas como propias.
Se desconoce, asimismo, qué factores hacen posibles estos cambios, aunque se sospecha que están implicados tanto un componente genético como factores endocrinos (un exceso de algunas hormonas puede afectar a la médula ósea y al timo) y factores externos (sustancias químicas, radiaciones, ciertos microorganismos, etc).
8. Inmunidad y trasplantes
En cirugía se entiende por trasplante la sustitución de un tejido u órgano o parte de él, dañado o enfermo, por otro sano. Dependiendo de la procedencia del órgano trasplantado se habla de:
a) Trasplantes autólogos. Cuando proceden de la misma persona que recibe el transplante.
b) Trasplantes isólogos o isogénicos. Cuando proceden de un gemelo univitelino.
c) Trasplantes alogénicos o alotrasplantes. Cuando proceden de otro individuo de la misma especie.
d) Trasplantes xenogénicos o xenotrasplantes. Cuando proceden de individuos de distinta especie.
El rechazo es la respuesta del sistema inmunitario de la persona a la que se le ha trasplantado un órgano, ya que responde contra los antígenos del órgano trasplantado por no reconocerlos como propios.
La aceptación o el rechazo del órgano trasplantado están relacionados con las reacciones inmunitarias de tipo celular, es decir, producidas por linfocitos T citotóxicos principalmente. El antígeno que provoca la respuesta inmune es el MHC de clase I de la superficie de las células trasplantadas. Si es del mismo organismo, como sucede en los dos primeros casos citados arriba, los linfocitos lo reconocen como propio. En caso contrario, los linfocitos citotóxicos, lisan y destruyen las células extrañas, y acuden macrófagos y todo tipo de glóbulos blancos para rechazar lo que detectan como una infección.
El proceso de rechazo puede iniciarse 48 horas después del trasplante. Esto se debe a una hipersensibilidad de tipo II (rechazo hiperagudo), o bien al cabo de varias semanas o meses como resultado de una hipersensibilidad de tipo IV originada por el contacto prolongado con los linfocitos TH.
Para evitar el rechazo se recomienda:
A) Elegir el donante apropiado. Cuanto mayor sea el parentesco entre donante y receptor, mayor será la posibilidad de que el sistema de antígenos de membrana sea parecido.
En este sentido el sistema HLA va a ser determinante, de manera que donante y receptor deben ser compatibles en dicho sistema.
En el sistema HLA existen unos lugares estratégicos denominados HLA-A, HLA-B, HLA-C, HLA-DR y HLD-Q, que nos indicarán si una persona puede ser compatible con otra en caso de trasplante. El antígeno presente en estos lugares es lo que nos va a indicar la posibilidad de aceptación del órgano del donante por parte del receptor. Dos personas serán compatibles cuando los antígenos localizados en esos lugares estratégicos sean bien idénticos o tener ciertas coincidencias. Como en cada punto pueden existir muchos antígenos, las combinaciones son numerosas y las posibilidades de coincidencia pequeñas. No obstante hay que señalar que existen haplotipos HLA muy frecuentes en la población general, lo que facilita la búsqueda de donantes no emparentados.
Un haplotipo (del griego haploos = simple) es una combinación de alelos ligados a múltiples loci que se transmiten juntos.
Por tanto, un donante es HLA-compatible cuando su huella genética controlada en los antígenos A, B, C, DR y DQ presenta una combinación molecular idéntica o con ciertas coincidencias con la combinación del receptor (es diferente según el tipo de trasplante).
B) Utilizar compuestos que inhiban la respuesta inmune: como tales inmunodepresores se utilizan en los trasplantes los corticoides y los agentes citostáticos.
Entre estos últimos podemos citar la ciclosporina (antibiótico que actúa selectivamente contra las células T implicadas en el rechazo al bloquear los receptores de las interleucinas), de esta forma el resto del sistema inmune queda intacto y no es necesario acudir a otros fármacos, además, que frenen las posibles infecciones al dañarse todo el sistema inmune, y que además producen efectos secundarios.
En la actualidad se está investigando la aplicación de anticuerpos selectivos contra los linfocitos que participan en el rechazo del tejido trasplantado, así como la inoculación repetida, antes del trasplante, de antígenos del donante que potencien su tolerancia.
La donación de órganos supone dar la vida, y mejorar la calidad de vida, de muchas personas. España es uno de los países con mejor sistema nacional de donantes, aunque en donaciones sanguíneas no andamos tan bien. Es importante ser donantes porque dada la dificultad de compatibilizar sigue muriendo gente por no encontrar órganos a tiempo.
8.1. Inmunidad y transfusiones de sangre
Sabemos que la sangre es un tipo de tejido cuya sustancia intercelular es líquida (plasma sanguíneo), es decir las células que lo componen están libres en dicho plasma. Podemos por tanto aceptar que una transfusión es un auténtico trasplante.
Se han detectado diversos antígenos en la superficie de la membrana de los eritrocitos, entre los cuales son importantes los utilizados para clasificar la sangre en los grupos del sistema AB0, así como el factor Rh.
8.1.1 Sistema AB0
Como hemos estudiado en cursos anteriores, recordaremos que su caracterización viene determinada por la presencia o ausencia de antígenos A y B en la superficie de los eritrocitos.
En función de esto se distinguen cuatro grupos sanguíneos:
a) Grupo A: presenta antígenos de tipo A.
b) Grupo B: presenta antígenos de tipo B.
c) Grupo AB: presenta antígenos de tipo A y antígenos de tipo B
d) Grupo 0: no presenta ningún tipo de antígenos.
Las transfusiones de sangre van a ser rechazadas siempre que el donante presente un tipo de antígeno del que carece el receptor. Ese rechazo se va a manifestar en la síntesis, por parte del receptor de anticuerpos específicos contra ese antígeno del que el receptor carece.
Dichos anticuerpos son los denominados anti-A o α y anti-B o β.
8.1.2 Sistema Rh
Es otro antígeno que puede estar presente en la membrana de los eritrocitos. Su presencia determina el grupo Rh+ y su ausencia el Rh─. Los que carecen de dicho factor no pueden recibir sangre de los que lo tienen, por tanto la tabla anterior se verá condicionada por la presencia o ausencia de dicho factor Rh.
Realmente los donantes universales serán los individuos de grupo 0 y Rh-, y los receptores universales serán los individuos de grupo AB y Rh+.
Este factor está determinado genéticamente y tiene gran importancia en los embarazos. Una mujer sin factor Rh (Rh─) es homocigótica recesiva. Si el padre es Rh+, puede ser homocigótico dominante o heterocigótico. En caso de que sea homocigótico dominante todos los descendientes serán Rh+, en caso de que sea heterocigótico la mitad de los descendientes serán Rh+ y la otra mitad Rh─.
Cuando una mujer Rh─ da a luz su primer hijo, es muy probable que en el parto haya contacto entre la sangre materna y la del hijo, con lo que la madre producirá anticuerpos anti Rh que permanecerán en su sangre. En un embarazo posterior, si el bebé es Rh+, los anticuerpos maternos pueden llegar al feto, originándose la destrucción de los glóbulos rojos fetales (eritroblatosis fetal), de consecuencias fatales para el feto.
Hoy en día, este trastorno se evita con sueroterapia, mediante la denominada inyección anti-Rh a la madre antes del parto, para que en ese momento se destruyan los pocos eritrocitos Rh+ del bebé que puedan pasar a la madre, evitando así que el sistema inmune de esta actúe y forme células de memoria. Este proceso debe repetirse antes del parto de cada bebé Rh+, para revenir la eritroblatosis de un posible embarazo posterior.
9. Inmunidad y cáncer
El sistema inmunitario interviene activamente en la inhibición del desarrollo del cáncer. Prueba de ello es que las personas inmunodeficientes, como, por ejemplo, los enfermos de sida, padecen con más frecuencia algunos tipos de tumores que los individuos sin alteraciones en su sistema inmunitario.
Un cáncer se inicia cuando ciertas células, por causas aún no aclaradas suficientemente, sufren una transformación que las induce a dividirse de manera rápida y descontrolada. Como consecuencia, se origina una masa de células sin las características propias (y, por tanto, las funciones) de las que proceden, con un metabolismo muy intenso y alterado.
Esta masa de células anormales, que recibe el nombre de tumor, invade los tejidos circundantes causando su destrucción.
Si su crecimiento es limitado, se habla de tumor benigno. Por el contrario, cuando las células se dividen sin límite y se extienden a otros órganos, se denomina tumor maligno o cáncer.
Se ha demostrado que las células transformadas, origen de los tumores, poseen en su superficie antígenos distintos a los de las células normales. Por esta razón, el organismo no las considera como células propias y desarrolla mecanismos inmunitarios, tanto inespecíficos como específicos, para destruirlas:
a) Las defensas inespecíficas están constituidas por los macrófagos y por las células NK, que eliminan a las células tumorales más eficazmente cuando tienen anticuerpos unidos a su membrana (opsonización).
También participan en la acción antitumoral algunas sustancias citotóxicas, como el factor de necrosis tumoral (TNF) producido por varias células del sistema inmunitario.
b) Las defensas específicas celulares consisten en la acción citotóxica causada por los linfocitos TC, que se unen a las células con antígenos alterados y provocan su destrucción. Además, los linfocitos TH, liberan linfocinas que favorecen la función de los linfocitos TC y la activación de los macrófagos y de los linfocitos B.
c) Las defensas específicas humorales son los anticuerpos que, tras su unión a las células cancerígenas, favorecen la acción de los macrófagos y también de las células NK, así como la activación del complemento por la vía clásica.
De esta forma, según la teoría de la vigilancia inmunitaria, el sistema inmunitario se encargaría de eliminar estas peligrosas células antes de que se multiplicaran masivamente y pudieran desarrollar un cáncer.
Este eficaz sistema, sin embargo, no siempre cumple su finalidad, pues en ocasiones se consigue eludir la acción inmunitaria y se produce un cáncer. Pese a que se ha especulado mucho en torno a la causa de este fenómeno, aún no se ha podido elaborar una explicación satisfactoria. Las hipótesis más aceptadas en la actualidad son las siguientes:
a) Las células cancerosas producen y segregan moléculas que interfieren en las defensas inmunitarias, desactivando, por ejemplo, los linfocitos TC, o provocando la estimulación de los linfocitos TS, lo cual disminuiría la eficacia de la respuesta.
b) Los antígenos de las células alteradas no son detectados por el sistema inmunitario debido a la falta de alguna de las moléculas necesarias para la «presentación antigénica» o bien porque están ocultos por otras moléculas que dificultan su identificación.
c) La existencia de una gran cantidad de antígenos en las células cancerosas provocaría el bloqueo, quizá irreversible, de todos los receptores de los linfocitos impidiendo con esto el reconocimiento de nuevas células alteradas.
d) La respuesta inmunitaria se desencadena con lentitud y cuando puede ser efectiva, el tumor ya se ha desarrollado. Esto resulta evidente en casos de inmunodeficiencias debidas a la edad avanzada, a la infección por el VIH o incluso a algunos tratamientos antitumorales que debilitan las defensas inmunitarias.
Debido al desconocimiento de las causas exactas que determinan la aparición de células alteradas que escapan a la acción destructiva del sistema inmunitario, el tratamiento contra el cáncer se basa fundamentalmente en las siguientes técnicas:
a) Extirpación quirúrgica.
b) Radioterapia, en la que se aplican radiaciones letales sobre el tumor.
c) Quimioterapia, que consiste en la administración de fármacos que destruyen las células que se dividen rápidamente.
Al actuar de forma inespecífica, estos fármacos ocasionan también la destrucción de otras células no cancerosas de división rápida, como las células del intestino, de la médula ósea y de los bulbos pilosos, con los consiguientes efectos secundarios (problemas digestivos, anemia, caída del pelo, etcétera).
Sin embargo, se está comenzando a aplicar un conjunto de técnicas basadas en la acción inmunitaria, que se denomina inmunoterapia antitumoral, entre las que figuran las siguientes:
a) Administración de interferón para tratar algunas leucemias.
b) Extracción de linfocitos del enfermo que posteriormente se activan por medio de linfocinas y se reintroducen en el organismo.
c) Creación de vacunas contra antígenos tumorales.
El desarrollo de la biotecnología aplicada a la inmunoterapia probablemente permitirá descubrir tratamientos eficaces en un futuro no muy lejano. En la actualidad, se están empezando a utilizar anticuerpos, específicos contra antígenos de las células cancerosas que llevan ligados fármacos letales para estas. De esta forma se podrá lograr destruir de una forma selectiva las células tumorales sin dañar las células normales.














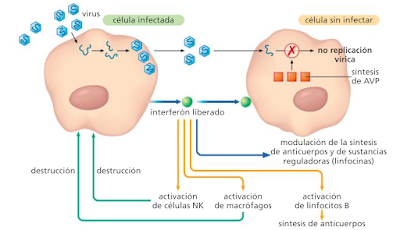


























































































.PNG)




.jpg)









No hay comentarios:
Publicar un comentario